微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为_________________。
(2)N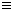 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N,中的______键比______键稳定(填“σ”或“π”)。
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N,中的______键比______键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___ (填“大”或“小”),可用作___(填代号)。
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3- 形成的晶体结构如下图所示。X的元素符号是_________,与同一个N3-相连的X+有_______个。

参考答案:(1)1s22s22p6
(2)π;σ
(3)小;b
(4)Cu;6
本题解析:
本题难度:一般
2、选择题 下列判断正确的是
[? ]
A.酸酐一定是氧化物
B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物
D.正四面体分子中键角一定是109。28’
参考答案:C
本题解析:
本题难度:简单
3、填空题 甲烷、甲醇、肼(N2H4)、氨和氢气等都可作为燃料电池的燃料。
(1)与甲醇互为等电子体的有机物分子式为:_________________, 甲醇的熔、沸点比甲烷的熔、沸点高,其主要原因是:______________________
(2)N2H4中N-N键键能__________(填“>”或“<” “=”) CH3CH3中C-C键键能,工业上将NH3或
(CH3)2CO与氯气反应后水解制取N2H4,(CH3)2CO中碳原子轨道的杂化类型为:_________、________,
1 mol(CH3)2CO中的π键数目为:_________。
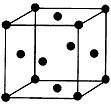
(3)用钛锰储氢合金储氢,与高压氢气钢瓶相比,具有重量轻、体积小的优点。锰原子外围电子排布式为:____________。金属钛的晶胞是面心立方结构(如图),则钛晶体的1个晶胞中钛原子数为:
________,钛原子的配位数为:________。
参考答案:(1)CH3SH;甲醇分子之间有氢键
(2)<;sp3杂化;sp2杂化;NA或6.02×1023
(3)3d54s2;4;12
本题解析:
本题难度:一般
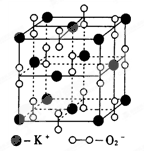
4、填空题 (9分)㈠如图是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)。晶体中氧的化合价可看作是部分为0价,部分为-2价。
 ?
?
⑴该结构与?的结构相似(填选项字母,下同)
A.NaCl? B.CsCl? C.干冰? D.SiO2
⑵钾、氧两元素所形成化合物的化学式是?
A.K2O? B.K2O2? C.K2O3? D.KO2
⑶下列对KO2晶体结构的描述正确的是?
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.每个 O2-周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3: 1
㈡如右图所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解池,其电极材料见右图:
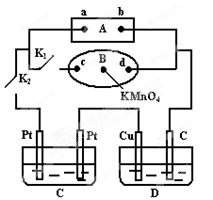
⑴关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为?极,通电一段时间后,观察到滤纸d端的电极反应式是?;
⑵已知C装置中溶液为Cu(NO3)2和Y(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如右图所示。
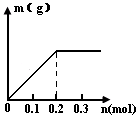
则Cu2+、Y3+、H+氧化能力由大到小的顺序是?;D装置中溶液是H2SO4,则电极C端的实验现象是_____?。
参考答案:(一)(1)A?(2)D?(3)CD
(二)(1)负极;2H++2e-=H2↑
(2)Cu2+>H+>Y3+;在C端开始有无色无味气体产生,一段时间后后红色物质析出
本题解析:(一)(1)根据晶胞的结构可知,该结构与氯化钠的结构相似,答案选A。
(2)根据晶胞结构可知,钾原子端个数是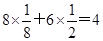 个。阴离子的个数是
个。阴离子的个数是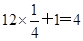 个,所以钾、氧两元素所形成化合物的化学式是KO2,答案选D。
个,所以钾、氧两元素所形成化合物的化学式是KO2,答案选D。
(3)晶体中与每个K+距离最近的K+有12个,A不正确;晶体中每个K+周围有6个O2-,每个O2-周围有6个K+,B不正确,C正确;晶体中,阴离子带1个负电荷,所以0价氧原子与-2价氧原子的数目比为3: 1,D正确,答案选CD。
(二)(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,这说明c端应该是阳极,所以电源b端为负极。d端是阴极,氢离子放电,则电极反应式是2H++2e-=H2↑。
(2)根据图像可知,当通过0.2mol电子时,析出的固体质量不再增加,所以溶液中只有铜离子能够得到电子而析出金属,即Y3+不能放电,这说明阳离子的氧化性强弱顺序是Cu2+>H+>Y3+;D中铜电极是阳极,失去电子,C端是阴极,溶液中的氢离子得到电子。随着反应的进行,溶液中的铜离子得到电子,所以电极C端的实验现象是在C端开始有无色无味气体产生,一段时间后后红色物质析出。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力。该题的关键明确常见晶体的结构特点以及电解池的工作原理,然后灵活运用即可。
本题难度:一般
5、选择题 有关晶体的下列说法中正确的是(?)
A.分子晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.金属晶体发生形变时,金属键发生断裂
D.氯化钠熔化时离子键未被破坏
参考答案:B
本题解析:A.分子间作用力一般只与物质的物理性质,例如溶沸点有关系,不正确
B.正确
C.金属晶体发生形变时,金属键并不断裂
D.氯化钠熔化的同时离子键断裂
答案为B
本题难度:简单