微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列方程式正确的是( )
A.将铁片投入稀盐酸中:2Fe+6H+=2Fe3++3H2↑
B.将醋酸滴入纯碱溶液:2H++CO32-=H2O+CO2↑
C.甲烷和氯气混合光照:CH4+2Cl2=CCl4+2H2
D.聚氯乙烯塑料的制备:nCH2=CHCl
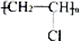
参考答案:A、铁与盐酸反应生成Fe2+,正确的离子方程式为Fe+2H+=Fe2++H2↑,故A错误;
B、醋酸为弱电解质,应写成化学式,不能写成离子形式,故B错误;
C、甲烷和氯气混合光照发生取代反应生成氯代烃和HCl,不是置换反应,故C错误;
D、氯乙烯含有C=C,在催化剂条件下发生加聚反应生成聚氯乙烯,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 下表中评价合理的是( )
| 选项 | ?化学反应及其离子方程式 | ?评价
A
Fe3O4与稀硝酸反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O
?正确
B
向碳酸镁中加入稀盐酸:CO32-+2H+═CO2+H2O
错误,碳酸镁不应该写成离子形式
C
向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓
?正确
D
FeBr2溶液与等物质的量的Cl2反应:
2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2
错误,Fe2+与Br-的化学计量数之比应为1:2
|
A.A正确
B.B正确
C.C正确
D.D正确
参考答案:A、Fe3O4与稀硝酸反应产生的气体是一氧化氮,不会产生氢气,故A错误;
B、碳酸镁是难溶物质,不应该写成离子形式,故B正确;
C、铵根离子能和氢氧根离子反应产生氨气或者是一水合氨,向硫酸铵溶液中加入氢氧化钡溶液,反应为:2NH4++Ba2++SO42-+2OH-═BaSO4↓+2NH3?H2O,故C错误;
D、亚铁离子的还原性强于溴离子,FeBr2溶液与等物质的量的Cl2反应为:2Fe2++3Cl2+4Br-═2Fe3++6Cl-+2Br2,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 下列离子方程式书写正确的是
A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++H++OH—+SO42—=BaSO4↓+H2O
B.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
参考答案:D
本题解析:A.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++2H++2OH—+SO42—=BaSO4↓+2H2O.错误。B.Cl2通入水中HClO是弱酸,应该写成化学式。离子方程式为:Cl2+H2O=H++Cl-+HClO。错误。C.氯化铝溶液中加入过量氨水,由于一水合氨是弱碱,不能溶解Al(OH)3:离子方程式为Al3++3NH3·H2O= Al(OH)3↓+3NH4+。错误。D.符合客观事实及离子方程式的书写原则。正确。
本题难度:一般
4、选择题 下列各组离子可能大量共存的是
A.pH=1的溶液中: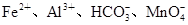
B.能与金属铝反应放出氢气的溶液中:
C.含有大量OH-的无色溶液中:
D.常温下水电离出的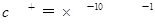 的溶液中:
的溶液中: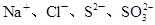
参考答案:D
本题解析:A项pH=1的溶液中含有大量H+,HCO3-不能大量存在,而且Fe2+和H+、MnO4-能发生氧化还原反应而不能共存,A错误;B项能与金属铝反应放出氢气的溶液可能是酸性溶液也可能是碱性溶液,在碱性溶液中NH4+不能大量存在, B错误;C项要求无色溶液,Cu2+显蓝色,C错误;D项常温下水电离出的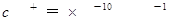 的溶液可能是酸性溶液也可能是碱性溶液,在酸性中S2-、SO32-不能大量存在,但在碱性条件下可以共存。
的溶液可能是酸性溶液也可能是碱性溶液,在酸性中S2-、SO32-不能大量存在,但在碱性条件下可以共存。
点评:注意附加条件的综合分析
本题难度:一般
5、选择题 在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是( )
A.1:9
B.1:1
C.1:2
D.1:4
参考答案:pH=12的Ba(OH)2溶液中C(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol;反应的硫酸氢钠物质的量为0.5x×10-2mol;设硫酸氢钠溶液体积为y,
依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;
所以得到:x×10-2-0.5x×10-2x+y=10-3;
得到x:y=1:4,
故选D.
本题解析:
本题难度:简单