微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验误差分析错误的是( )
A.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
参考答案:A.湿润的pH值试纸可以稀释碱液,溶液中氢氧根离子根据减小,测定的溶液碱性减弱,测定值偏小,故A正确;
B.定容时俯视刻度线,导致所配溶液的体积偏小,结合c=nV可知,所配溶液的浓度判断,故B错误;
C.滴定前滴定管内无气泡,终点读数时有气泡,气体占据液体应占有的体积,会导致所测溶液体积偏小,故C正确;
D.测定中和反应的反应热时,将碱缓慢倒入酸中,导致热量损失过大,所测温度值偏小,故D正确;
故选B.
本题解析:
本题难度:简单
2、选择题 (安徽省合肥八中2008—2009学年度高三第三次月考,化学,9)实验室有四个药品橱,已存放如下药品
药品橱
| 甲橱
| 乙橱
| 丙橱
| 丁橱
|
药品
| 盐酸、硫酸
| 氢氧化钠、氢氧化钙
| 红磷、硫
| 铜、锌
|
实验室新购进一些活性炭,应将它存放在?(?)
A.甲橱
B.乙橱
C.丙橱
D.丁橱
参考答案:C
本题解析:甲橱中盛放的是酸性物质,乙橱中盛放的是碱性物质,丙橱中盛放的是非金属单质,丁橱中盛放的是金属单质,而活性炭属于非金属单质,故应盛放在丙橱中。
本题难度:一般
3、填空题 信息时代产生的大量电子垃圾对环境造成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜晶体的路线:
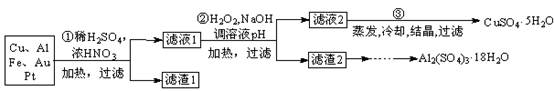
回答下列问题:
⑴第①步Cu与酸反应的离子方程式为?;得到滤渣1的主要成分为?。
⑵第②步加入H2O2的作用是?,使用H2O2的优点是?;调节pH的目的是使?生成沉淀。
⑶用第③步所得CuSO4·5H2O制备无水CuSO4的方法是?。
⑷由滤渣2制取Al2(SO4)3·18H2O,探究小组设计了三种方案:
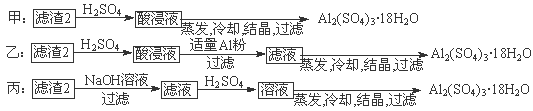
上述三种方案中,?方案不可行,原因是?;
从原子利用率角度考虑,?方案更合理。
⑸探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g 试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol/L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++ H2Y2-=CuY2-+ 2H+
写出计算CuSO4·5H2O质量分数的表达式ω=?;
下列操作会导致CuSO4·5H2O含量测定结果偏高的是?。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除静可与EDTA反应的干扰离子
参考答案:⑴Cu+4H++2NO3- Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-
Cu2++2NO2↑+2H2O或3Cu+8H++2NO3- 3Cu2++2NO↑+4H2O;Au、Pt
3Cu2++2NO↑+4H2O;Au、Pt
⑵把Fe2+氧化为Fe3+;不引入杂质,产物对环境物无污染;Fe3+和Al3+。
⑶在坩埚中加热脱水
⑷甲;甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质;乙。
⑸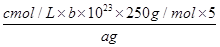 ×100%;c。
×100%;c。
本题解析:(1)浓硝酸与稀硝酸混合,硝酸可能为浓溶液,也可能为稀溶液,所以两个离子方程式都可;Au、P他不和硝酸反应,所以滤渣1的主要成分为:Au、Pt。
(2)第②步加H2O2的作用是把Fe2+氧化为Fe3+;H2O2作氧化剂。其还原产物为H2O,所以该氧化剂的优点是不引入杂质,产物对环境物无污染;调溶液PH的目的是使Fe3+和Al3+形成沉淀。
(3)第③步由五水硫酸铜制备硫酸铜的方法应是在坩埚中加热脱水。
(4)制备硫酸铝晶体的甲、乙、丙三种方法中,甲方案在滤渣中只加硫酸会生成硫酸铁和硫酸铝,冷却、结晶、过滤得到的硫酸铝晶体中混有大量硫酸铁杂质,方法不可行。乙和丙方法均可行。乙方案先在滤渣中加H2SO4,生成Fe2(SO4)3和Al2(SO4)3,再加Al粉和Fe2(SO4)3生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体。丙方案先在滤渣中加NaOH,和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3, 蒸发、冷却、结晶、过滤可得硫酸铝晶体。但从原子利用角度考虑方案乙更合理,因为丙加的NaOH和制备的Al2(SO4)3的原子组成没有关系,造成原子浪费。
(5)根据离子方程式,Cu2+的物质的量等于EDTA的物质的量,所以由EDTA的物质的量可求出CuSO4?5H2O的物质的量,因为配制了100mL CuSO4溶液,每次取20.00mL实验,所以再乘以5,可得样品中CuSO4?5H2O的物质的量,进而求出CuSO4?5H2O的含量;a、未干燥锥形瓶,为正确操作,不影响结构;b、滴定终点时滴定管尖嘴中产生气泡,使标准液的体积测量值变小,结构偏小;c、未除净可与EDTA反应的干扰离子,增加了EDTA的用量,使结果偏高。
本题难度:困难
4、填空题 (10分)用下列装置能达到有关实验目的的是
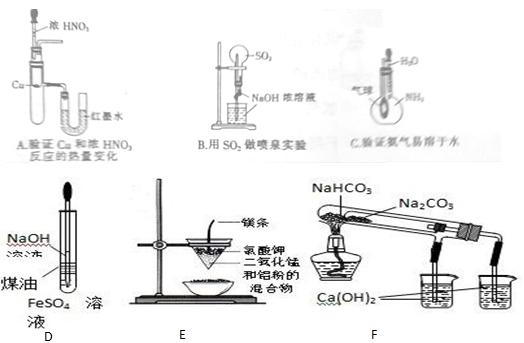
写出A、B、F中发生的化学反应方程式:
A?
B?
F?(试管中的反应)
参考答案:
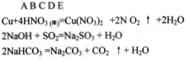
本题解析:略
本题难度:一般
5、填空题 今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液,欲将Ba2+、Ag+、Fe3+
分离,分别得到三种元素的不溶物,按下图所示实验:
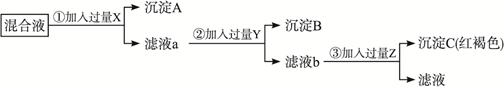
(1)加入的试剂(写化学式):X______,Y______,Z______。生成的沉淀(写化学式):A______,B______,C______。
(2)写出反应①②③的离子方程式:①____________,②____________,③____________。
参考答案:(1)HCl或NaClH2SO4或Na2SO4NaOHAgClBaSO4Fe(OH)3
(2)Ag++Cl-══AgCl↓Ba2++SO2-4══BaSO4↓Fe3++3OH-══Fe(OH)3↓
本题解析:根据沉淀C为红褐色,所以判断是Fe(OH)3 , Z为NaOH。因为很多阴离子能与Ag+反应生成沉淀所以应先将Ag+沉淀下来,否则会对Ba2+、Fe3+生成沉淀产生干扰
本题难度:简单