微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能正确表示下列化学反应的离子方程式是
A.饱和石灰水跟稀硝酸反应Ca(OH)2 + 2H+ = Ca2+ + 2H2O
B.钠和水反应Na+2H2O=Na++H2↑+2OH-
C.大理石与盐酸反应 CaCO3+2H+=Ca2++H2O+CO2↑
D.硫酸与氢氧化钡溶液反应 Ba2++OH-+H++SO42-= BaSO4↓+ H2O
参考答案:C
本题解析:A.在饱和石灰水中物质是以离子的形式存在的,离子方程式为OH- + H+ =H2O。错误。B.钠和水反应 电子、电荷不守恒。应该为:2Na+2H2O=2Na++H2↑+2OH-.错误。C.大理石与盐酸反应CaCO3+2H+=Ca2++H2O+CO2↑符合事实及拆写原则。正确。D.不符合分液事实。应该为:Ba2++2OH-+ 2H++SO42-= BaSO4↓+2 H2O.错误。
本题难度:简单
2、选择题 下列离子方程式书写正确的是
A.用氢氧化钠溶液出去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O
B.用浓盐酸与MnO2反应制取少量氯气:
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
D.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
参考答案:A
本题解析:分析:A.反应生成偏铝酸钠和水;
B.H原子不守恒、电荷不守恒;
C.强碱溶液中应生成水,不会生成H+;
D.发生氧化还原反应生成亚铁离子、碘、水.
解答:A.用氢氧化钠溶液出去铝表面的氧化膜的离子反应为Al2O3+2OH-═2AlO2-+H2O,故A正确;
B.用浓盐酸与MnO2反应制取少量氯气的离子反应为MnO2+4H++2Cl- Mn2++Cl2↑+2H2O,故B错误;
Mn2++Cl2↑+2H2O,故B错误;
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故C错误;
D.氢氧化铁溶于氢碘酸中的离子反应为2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,故D错误;
故选A.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意离子反应的书写方法及发生的氧化还原反应即可解答,题目难度较大.
本题难度:一般
3、实验题 (4分)如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
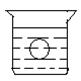
 (1)该实验中,观察到的现象有
(1)该实验中,观察到的现象有
①?,?
②?。
(2)写出该实验中反应的离子方程式?
?。
参考答案:(1)溶液里有白色沉淀产生;(2)小球下沉到烧杯底;(3)Ba2++2OH-+2H++SO42- =BaSO4↓+4H2O;
本题解析:随着Ba(OH)2溶液的注入,会与H2SO4溶液反应生成沉淀,导致溶液的浓度越来越小,小球受到的浮力逐渐减小,最终会使小球下沉到烧杯底。
本题难度:简单
4、选择题 下列各组物质的稀溶液相互反应,无论是前者滴入后者还是后者滴入前者,反应现象相同的是
A.AlCl3和NaOH
B.硫酸铝和浓氨水
C.NaAlO2和H2SO4
D.氨水和AgNO3溶液
参考答案:B
本题解析:A、C、D三选项在互相滴加的过程中,均会产生:产生白色沉淀后再逐渐消失或一开始无白色沉淀,随后出来白色沉淀的现象。而B只有白色沉淀产生的现象。
本题难度:一般
5、选择题 室温下,下列各组离子在指定溶液中能大量共存的是
A.FeCl3溶液中:Na+、I-、Cl-、
B.常温下,=0.1?mol?L-1的溶液中:K+、Na+、、
C.pH=12的溶液中:K+,Mg2+、、
D.由水电离出的c(H+)=1×10-13mol?L-1的溶液中:Na+、Ca2+、Cl-、
参考答案:B
本题解析:分析:A.Fe3+、I-离子之间发生氧化还原反应;
B.常温下,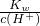 =0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性;
=0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性;
C.pH=12的溶液,显碱性,离子结合生成沉淀;
D.由水电离出的c(H+)=1×10-13mol?L-1的溶液,为酸或碱溶液.
解答:A.Fe3+、I-离子之间发生氧化还原反应,则不能共存,故A错误;
B.常温下,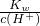 =0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间不反应,能共存,故B正确;
=0.1?mol?L-1的溶液,c(OH-)=0.1mol/L,溶液显碱性,该组离子之间不反应,能共存,故B正确;
C.pH=12的溶液,显碱性,Mg2+、OH-离子结合生成沉淀,则不能共存,故C错误;
D.由水电离出的c(H+)=1×10-13mol?L-1的溶液,为酸或碱溶液,HCO3-既能与酸反应又能与碱反应,一定不能共存,故D错误;
故选B.
点评:本题考查离子的共存,明确习题中的隐含信息及离子之间的反应即可解答,注意隐含信息的挖掘和使用是解答的关键,题目难度不大.
本题难度:困难