微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式中,书写正确的是
A.氯气溶于水:H2O+Cl2=2H++ClO-+Cl-
B.将铝粉投入氢氧化钠溶液中:2Al+2OH-=2+H2↑
C.铁粉与氯化铁溶液反应:Fe+Fe3+=2Fe2+
D.过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH-+O2↑
参考答案:D
本题解析:分析:A、生成的次氯酸是弱电解质,写出化学式;
B、根据电荷守恒判断;
C、方程式两边电荷不守恒;
D、过氧化钠和水反应生成氢氧化钠和氧气.
解答:A、次氯酸不能拆开,正确的离子方程式是:H2O+Cl2=H++HClO+Cl-,故A错误;
B、电荷不守恒,氧原子不相等,正确反应的离子方程式是:2H2O+2Al+2OH-=2AlO2-+3H2↑,故B错误;
C、电荷不守恒,正确的离子方程式是:Fe+2Fe3+=32Fe2+,故C错误;
D、过氧化钠和水反应离子方程式是:2Na2O2+2H2O=4Na++4OH-+O2↑,故D正确;
故选D.
点评:本题考查了离子方程式的书写,次氯酸是弱电解质,不能拆开,注意电荷守恒的应用,本题难度不大.
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.将少量SO2通入漂白粉溶液中:CaSO3↓+2HClO
B.CuSO4溶液与少量Ba(OH)2溶液反应:+Cu(OH)2↓
C.Fe2O3与氢碘酸反应:
D.向双氧水中滴加少量酸性高锰酸钾溶液,溶液的紫红色褪去:
参考答案:B
本题解析:分析:A、次氯酸具有强氧化性,亚硫酸钙被氧化为硫酸钙;
B、硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀;
C、三价铁离子具有氧化性,氧化碘离子为碘单质;
D、原子不守恒.
解答:A、次氯酸具有强氧化性,亚硫酸钙被氧化为硫酸钙,将少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++3ClO-=CaSO4↓+2HClO+Cl-,故A错误;
B、硫酸铜和氢氧化钡反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故B正确;
C、Fe2O3具有氧化性,I-具有还原性,二者会发生氧化还原反应,离子方程式为Fe2O3+6H++2I-=2Fe3++I2+3H2O,故C错误;
D、选项中原子不守恒,离子方程式为:20H-+2MnO4-+5H2O2=2Mn2++5O2↑+10H2O,故D错误;
故选B.
点评:本题考查离子方程式正误判断和书写方法,注意氧化性离子和还原性离子的分析,题目难度中等.
本题难度:困难
3、选择题 在含1 mol复盐NH4Al(SO4)2液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3?H2O的物质的量为
A.0.8mol
B.l mol
C.0.2mol
D.0.4mol
参考答案:C
本题解析:当生成l.6 mol BaSO4沉淀时,加入1.6molBa(OH)2,提供了3.2mol氢氧根离子,此时1mol铝离子消耗了3mol,并生成1mol氢氧化铝,剩余0.2mol氢氧根和0.2mol铵根离子发生了反应生成0.2molNH3?H2O。选C。
本题难度:一般
4、填空题 铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强。工业上往往采取下列循环工艺防止铬的污染:
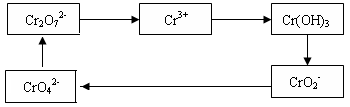
完成下列填空:
(1)含Cr2O72-离子的废水在酸性条件下用Fe3O4处理,反应的离子方程式如下:
?Cr2O72- +?Fe3O4 +??H+ →?Cr3+ +?Fe3+ +?H2O
配平上述离子反应方程式,并标出反应中电子转移的方向和数目。
(2)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。写出从该沉淀中分离出Cr(OH)3的离子方程式?、
?。
(3)回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
① Cr2O72- +6I- + 14H+ →3I2 + 2Cr3+ + 7H2O?② 2S2O32- + I2→S4O62- + 2I-
准确称取纯净的K2Cr2O7 0.1225g ,配成溶液,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为?(保留四位有效数字)。
参考答案:(1)
 ?(4分,其中配平:2分,标出电子转移方向:1分,数目:1分)
?(4分,其中配平:2分,标出电子转移方向:1分,数目:1分)
(2)Cr(OH)3+OH-→CrO2-+2H2O?(1分)
CrO2- + 2H2O + CO2→Cr(OH)3↓+HCO3-(1分)
(3)0.1000 mol/L(2分,有效数字有错或没有单位扣1分)。
本题解析:(1)根据质量守恒和得失电子守恒不难写出相关化学方程式;
(2)根据反应物和产物,不难写出相关化学方程式:Cr(OH)3+OH-→CrO2-+2H2O ;CrO2- + 2H2O + CO2→Cr(OH)3↓+HCO3-;
(3)根据方程式得到:Cr2O72- -------3I2 ------6S2O32- ×6=0.025L×c(Na2S2O3),c(Na2S2O3)="0.1000" mol/L。
×6=0.025L×c(Na2S2O3),c(Na2S2O3)="0.1000" mol/L。
本题难度:困难
5、选择题 属于氧化还原反应的离子方程式的是(?)
A.CaCO3+2H+= Ca2++CO2↑+H2O
B.2Fe2++Cl2= 2Fe3++2Cl-
C.HCO3-+H+= CO2?+H2O
D.2Na+2H2O = 2Na++2OH-+H2↑
参考答案:BD
本题解析:氧化还原反应要有化合价的变化,B和D中都有化合价的变化,所以属于氧化还原反应的离子方程式。答案选BD。
考点;氧化还原反应的判断
点评:判断一个反应是不是氧化还原反应,主要看化合价有没有变化,如果化合价发生改变,则属于氧化还原反应。
本题难度:一般