微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时下列有关叙述正确的是?( )
①正反应速率一定大于逆反应速率?②反应物的浓度一定降低?③反应物的转化率一定增大?④生成物的产量一定增加?⑤生成物的体积分数一定增加.
A.①②③④⑤
B.①④
C.①②④
D.①②
参考答案:①正反应速率大于逆反应速率,平衡向正反应方向移动,故①正确;
②如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大,故②错误;
③如增加某反应物的物质的量,平衡向正方向移动,但该反应物的转化率反而减小,故③错误;
④化学平衡向正反应方向移动,生成物的产量一定增大,故④正确;
⑤如增加反应物的物质的量,平衡向正方向移动,若增加的多,转化的少,则生成物的体积分数反而减小,故⑤错误.
故选B.
本题解析:
本题难度:简单
2、填空题 一定温度下,在一定容积的密闭容器中发生如下可逆反应:2A(g)+B(g) 2C(g) 在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。
2C(g) 在反应过程中,C的物质的量n(C)随时间的变化关系如下图所示(从t1时间开始对反应体系升高温度)。

试回答下列问题:
(1)p点时,反应的v(正)___(填“>”“<”或“=”) v(逆)。
(2)此反应的正反应为___(填“放”或“吸”)热反应。
(3)a、b两点的正反应速率:v(a)___(填“>”“<” 或“=”)v(b)。
参考答案:(1)=
(2)放
(3)<
本题解析:
本题难度:一般
3、选择题 在一体积不变的密闭容器中发生如下化学反应:2A(g)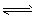 B(g)+C(g)。当物质A的起始浓度为1.0
B(g)+C(g)。当物质A的起始浓度为1.0
mol·L-1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如下图所示:
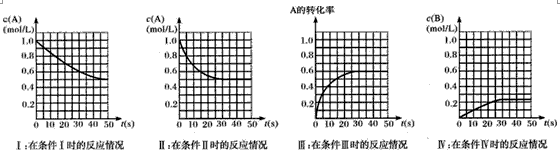
则下列有关说法中正确的是
[?]
A.条件I、条件Ⅱ时的反应温度不同,压强相同
B.条件I时可能未使用催化剂,条件Ⅱ时可能使用了催化剂
C.条件Ⅲ时的平衡混合物中,物质C的浓度等于0. 6mol·L-1
D.条件Ⅳ和条件Ⅱ相比较,条件Ⅳ时可能缩小了容器体积
参考答案:B
本题解析:
本题难度:一般
4、简答题 I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术处理尾气,化学方程式为2NO+2CO
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5
c(NO)/mol?L-1
1.00×10-3
4.50×10-4
2.50×10-4
1.50×10-4
1.00×10-4
1.00×10-4
c(CO)/mol?L-1
3.60×10-3
3.05×10-3
2.85×10-3
2.75×10-3
2.70×10-3
2.70×10-3
|
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的△H______0(填“>”、“<”或“=”).
(2)前2s内的平均反应速度v(N2)=______.
(3)该温度下,反应的平衡常数K=______.
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如图一所示.
(1)该电池正极的电极反应式为______.
(2)以上述电池为电源,构成图二电解池,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式______.
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸)______.
参考答案:I、(1)因该反应2NO(g)+2CO(g)催化剂.△2CO2(g)+N2(g)中气体减少,△S<0,由反应能够自发进行,则△H-T△S<0,即该反应一定是放热才有可能自发进行,放热反应中△H<0,
故答案为:<;
(2)由表格中的数据可知2s内NO浓度的变化量为1.00×10-3-2.50×10-4=7.50×10-4,则υ(NO)=7.5×10-4mol/l2s=3.75×10-4mol?L-1?s-1;由化学反应速率之比等于化学计量数之比,则υ(N2)=12υ(NO)=1.875×10-4mol?L-1?s-1;
故答案为:1.875×10-4mol?L-1?s-1;
(3)分析图表数据,依据化学平衡三段式列式计算平衡浓度:
2NO+2CO催化剂
本题解析:
本题难度:一般
5、填空题 在一定温度下,在一体积固定的密闭中加入2mol X和1mol Y,发生如下反应:
2X(g)+Y(g)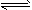 aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为
aZ(g)+W(g) △H=-Q kJ·mol-1(Q>0)(a是正整数)当反应达到平衡后,反应放出的热量为
Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________,其理由是__________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、0.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_____________(用含Q、Q1的代数式表示)。
参考答案:(1)减小
(2)1
(3)正确;2molX和1molY不可能完全反应
(4)A
(5)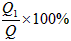
本题解析:
本题难度:一般