|
高中化学知识点大全《离子方程式的书写及正误判断》试题预测(2017年最新版)(十)
2017-08-08 03:54:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式正确的是BD
A.氨气通入盐酸溶液 HCl+NH3 ="=" NH4Cl
B.澄清的石灰水跟盐酸反应 H++OH- ="=" H2O
C.碳酸钡溶于醋酸 BaCO3+2H+ ="=" Ba2++H2O+CO2↑
D.金属钠跟水反应 Na+2H2O ="=" Na++2OH-+H2↑
|
参考答案:B
本题解析:氯化铵用离子表示,A不正确。醋酸是弱酸,用化学式表示。D中电子得失不守恒,所以正确的答案选B。
本题难度:一般
2、填空题 (12分)工业上采用下列工艺流程将石油废气中的硫化氢转化为硫酸和氢气等产品以防止污染。
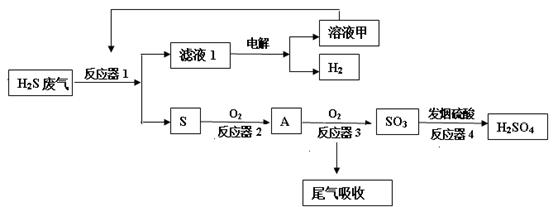
(1)反应器1中装有硫酸铁的酸性溶液。
①配制硫酸铁溶液时,需加入适量的硫酸,请用化学平衡移动原理解释原因 。
②反应器1中发生反应的离子方程式是______.
(2)反应器3中发生反应的化学方程式是 。
(3)工业上用氨水和热空气吸收处理尾气中的二氧化硫以生产氮肥,该反应的化学方程式是______.
(4)电解滤液1的工作原理示意图如下:
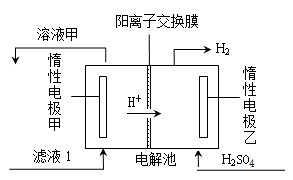
①乙电极是 (填“阴”或“阳”)极。
②甲电极的电极反应式是 。
③电解滤液1的离子方程式是 。
参考答案:12分)
(1)①Fe3++3H2O Fe(OH)3+3H+,加入硫酸,增加c(H+),使平衡逆向移动,抑制Fe3+水解(2分) Fe(OH)3+3H+,加入硫酸,增加c(H+),使平衡逆向移动,抑制Fe3+水解(2分)
②2Fe3++H2S=2Fe2++2H++S(2分)
(2)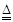 2SO2+O2 2SO2+O2 2SO3(2分) 2SO3(2分)
(3)4NH3?H2O+2SO2+O22(NH4)2SO4+2H2O(2分)
(4)①阴(1分)②Fe2+-e-==Fe3+(1分)③2Fe2++2H+ 2Fe3++H2↑(2分) 2Fe3++H2↑(2分)
本题解析:①硫酸铁水解使溶液显酸性,Fe3++3H2O Fe(OH)3+3H+,加入硫酸,增加c(H+),使平衡逆向移动,抑制Fe3+水解。②硫酸铁和硫化氢反应生成硫酸亚铁和硫和硫酸,方程式为:2Fe3++H2S=2Fe2++2H++S,(2)A为硫和氧气生成的二氧化硫,在反应器3中二氧化硫和氧气反应生成三氧化硫,方程式为:2SO2+O2 Fe(OH)3+3H+,加入硫酸,增加c(H+),使平衡逆向移动,抑制Fe3+水解。②硫酸铁和硫化氢反应生成硫酸亚铁和硫和硫酸,方程式为:2Fe3++H2S=2Fe2++2H++S,(2)A为硫和氧气生成的二氧化硫,在反应器3中二氧化硫和氧气反应生成三氧化硫,方程式为:2SO2+O2 2SO3(3)氨水和氧气和二氧化硫反应生成硫酸铵,方程式为:4NH3?H2O+2SO2+O2 2SO3(3)氨水和氧气和二氧化硫反应生成硫酸铵,方程式为:4NH3?H2O+2SO2+O2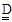 2(NH4)2SO4+2H2O(4)①乙电极附近氢离子反应生成氢气,所以为阴极;②甲电极处加入的硫酸亚铁,亚铁离子失去电子变成铁离子,电极反应为:Fe2+-e-==Fe3+③总反应为硫酸亚铁和硫酸电解生成硫酸铁和氢气,离子方程式为:2Fe2++2H+ 2(NH4)2SO4+2H2O(4)①乙电极附近氢离子反应生成氢气,所以为阴极;②甲电极处加入的硫酸亚铁,亚铁离子失去电子变成铁离子,电极反应为:Fe2+-e-==Fe3+③总反应为硫酸亚铁和硫酸电解生成硫酸铁和氢气,离子方程式为:2Fe2++2H+ 2Fe3++H2↑。 2Fe3++H2↑。
考点:实验方案的设计,电解原理的应用
本题难度:困难
3、填空题 (共6分)A、B、C是中学化学常见的三种有色物质,它们由Na、O、N、Cl等一种或两种元素组成,均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂。请写出A、B、C分别与水反应的离子方程式。
⑴ A与H2O __________________________________。
⑵ B与H2O _______________ __________________。
⑶ C与H2O __________________________________。
参考答案:(6分,每空2分)
⑴ 2 Na2O2 + 2H2O=4Na++4OH -+ O2↑ ⑵ Cl2 + H2O=H++Cl -+ HClO
⑶ 3NO2 + H2O=2H++NO3 - + NO
本题解析:Na、O、N、Cl中一种或两种元素组成的有色物质有Na(银白色),Na2O(白色),Na2O2(淡黄色),NO2(红棕色),Cl2(黄绿色),然后考虑上述物质与水反应,是氧化还原反应,但水既不是氧化剂也不是还原剂,符合条件的是Na2O2,Cl2,NO2
本题难度:一般
4、填空题 25℃时,将0.01 mol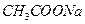 和0.002 mol 和0.002 mol 溶于水,形成1L混合溶液: 溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ;
② ;
③ 。
(2)溶液中共有七种不同的粒子(指分子和离子)。在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 ; 和 两种粒子物质的量之和等于0.01 mol。
参考答案:(1)(每空2分) ① H2O H+ + OH-; H+ + OH-;
② CH3COOH CH3COO- + H+; CH3COO- + H+;
③ CH3COO- + H2O CH3COOH + OH- CH3COOH + OH-
(2)(每空1分) Na+ , Cl-; CH3COO-和CH3COOH。
本题解析:略
本题难度:一般
5、选择题 下表中对应关系错误的是
A
| NaCl=Na++Cl-;NH3?H2O NH4++OH- NH4++OH-
| 均属于电离方程式
| B
| Ba2++SO42-=BaSO4↓;
HCO3-+OH-=CO32-+H2O
| 均可表示一类反应
| C
| SO2使酸性高锰酸钾溶液褪色;
SO2使碱性酚酞溶液褪色
| 均属于SO2的同一性质
| D
| Cl2+2NaOH=NaCl+NaClO+H2O;
3S+ 6NaOH=2Na2S+Na2SO3+3H2O;
| Cl2和S在反应中既作氧化剂又作还原剂
|
参考答案:C
本题解析:A.NaCl、NH3?H2O都是电解质,上述表示的是电离方程式。前者完全电离,电离方程式用等号:“===”,后者是弱电解质,电离方程式用可逆号:“ ”,正确;B.两个式子都是离子方程式,是表示一类反应,正确;C. SO2使酸性高锰酸钾溶液褪色,是由于SO2的还原性,被酸性高锰酸钾溶液氧化,后者是由于SO2是酸性气体,与碱发生反应使溶液的碱性减弱,所以酚酞溶液红色褪去,褪色的原因不同,错误;D.在这两个反应中,元素Cl、S化合价既升高,又降低,因此都是在反应中既作氧化剂又作还原剂,正确。 ”,正确;B.两个式子都是离子方程式,是表示一类反应,正确;C. SO2使酸性高锰酸钾溶液褪色,是由于SO2的还原性,被酸性高锰酸钾溶液氧化,后者是由于SO2是酸性气体,与碱发生反应使溶液的碱性减弱,所以酚酞溶液红色褪去,褪色的原因不同,错误;D.在这两个反应中,元素Cl、S化合价既升高,又降低,因此都是在反应中既作氧化剂又作还原剂,正确。
考点:考查化学符号或方程式、现象的原因解释的正误判断的知识。
本题难度:一般
|