微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能正确表示下列反应的离子方程式是( )
A.硫酸铝溶液中加入过量氨水 Al3++3OH﹣=Al(OH)3↓
B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32﹣=CaCO3↓+2OH﹣
C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH﹣=ClO﹣+Cl﹣+H2O
D.稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑
参考答案:C
本题解析:A.反应生成氢氧化铝沉淀和硫酸铵;
B.澄清石灰水应写成离子形式;
C.反应生成氯化钠、次氯酸钠、水;
D.反应生成硫酸亚铁和氢气.
解:A.硫酸铝溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故A错误;
B.碳酸钠溶液中加入澄清石灰水的离子反应为Ca2++CO32﹣=CaCO3↓,故B错误;
C.冷的氢氧化钠溶液中通入氯气的离子反应为Cl2+2OH﹣=ClO﹣+Cl﹣+H2O,故C正确;
D.稀硫酸中加入铁粉的离子反应为Fe+2H+=Fe2++H2↑,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确发生的化学反应及离子反应方程式的书写方法即可 解答,题目难度不大.
本题难度:一般
2、选择题 向100 mol FeBr2的溶液中,通入3 mol Cl2 。反应后溶液中Br-和Cl-的物质的量浓度相等,则溶液中发生反应的离子方程式为
A.2Fe2++Cl2 = 2Fe3++2Cl-
B.2Br-+Cl2 = Br2+2Cl-
C.4Fe2++2Br-+3Cl2 = Br2+4Fe3++6Cl-
D.2Fe2++4Br-+3Cl2 = 2Br2+2Fe3++6Cl-
参考答案:C
本题解析:由于亚铁离子的还原性强于溴离子的,所以氯气首先氧化亚铁离子,设溴化亚铁的物质的量是x,则由于反应后溶液中Br-和Cl-的物质的量浓度相等,所以x+(2x-6)=6,解得x=4,因此选项C正确,答案选C。
点评:如果同一种氧化剂能和不同的还原剂混合,氧化剂首先氧化还原性最强的还原剂;其次在计算时应该利用好电子的得失守恒。
本题难度:一般
3、选择题 下列离子方程式中正确的是
A.过量的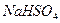 与
与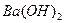 溶液反应:
溶液反应: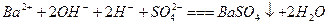

B.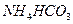 溶液与过量KOH溶液反应:
溶液与过量KOH溶液反应: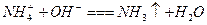

C.氯化铝溶液中加入过量氨水: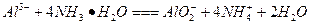

D.澄清石灰水与少量小苏打溶液混合: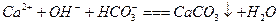
参考答案:AD
本题解析:B项中KOH溶液过量,未考虑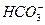 与
与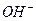 的反应,故错,C项中
的反应,故错,C项中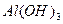 不溶于过量的氨水,产物主要是
不溶于过量的氨水,产物主要是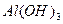 沉淀,错。
沉淀,错。
本题难度:一般
4、选择题 下列说法及对应的离子方程式均正确的是
A.铁溶于稀HNO3,溶液变黄色:3Fe + 8H+ + 2NO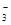 = 3Fe2+ + 2NO↑ + 4H2O
= 3Fe2+ + 2NO↑ + 4H2O
B.用惰性电极电解AlCl3溶液:Al3+ + 3Cl- + 3H2O  Al(OH)3↓ + 3/2H2↑ + 3/2Cl2↑
Al(OH)3↓ + 3/2H2↑ + 3/2Cl2↑
C.用酚酞作指示剂,在Na2CO3溶液中滴入乙酸溶液:CO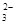 + 2CH3COOH = 2CH3COO- + H2O + CO2↑
+ 2CH3COOH = 2CH3COO- + H2O + CO2↑
D.在K2Cr2O7溶液中滴入NaOH溶液,溶液变为橙色:Cr2O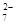 (橙)+ H2O
(橙)+ H2O  2CrO
2CrO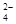 (黄)+2H+
(黄)+2H+
参考答案:B
本题解析:A、溶液变黄色,Fe被氧化为Fe3+,错误;B、Cl?失电子转化为Cl2,H2O电离出的H+转化为H2,正确;C、用酚酞作指示剂,Na2CO3与CH3COOH生成NaHCO3,错误;D、溶液变为橙色,说明生成了Cr2O72?,离子方程式为:2 CrO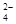 (黄)+2H+
(黄)+2H+  ?Cr2O
?Cr2O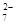 (橙)+ H2O,错误。
(橙)+ H2O,错误。
本题难度:一般
5、填空题 (10分)已知反应:3NO2+H2O==2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为?。
(2)氧化剂与还原剂的质量比为?,氧化产物与还原产物的物质的量之比为?。
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为?。
(4)写出HNO3与石灰水反应的离子方程式?。
参考答案:(10分,每空2分)(1)3NO2+H2O==2H++2NO3-+NO (2分)
(2)1:2? 2:1 (4分) (3)0.1mol (2分)(4)(5)H++OH-=H2O? (2分)
本题解析:(1)NO2和H2O和NO均为氧化物,不能改写成离子形式,硝酸是强酸,要改写成离子形式,故为:3NO2+H2O==2H++2NO3-+NO ;(2)NO2中的氮元素有的变成了+5,有的变成了+2,故二氧化氮既做氧化剂,又做还原剂,3mol的NO2中有2mol化合价升高,被氧化,做还原剂,1mol化合价降低,做氧化剂,故氧化剂和还原剂的质量比为1:2,氧化产物是2mol硝酸时,生成1mol的还原产物NO,故物质的量之比为:2:1;(3)标准状况下的体积除以22,4mol/L得物质的量为0.15mol,其中有0,1mol化合价升高成+5价,失去0.1mol电子,故转移电子数目为0.1mol;(4)硝酸和石灰水反应的实质是强酸与强碱发生的酸碱中和反应,故为:H++OH-=H2O。
本题难度:一般