| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《离子方程式的书写及正误判断》试题预测(2017年最新版)(四)
参考答案:A 本题解析:离子方程式正误判断——注意“七查”。1.“一查”是否符合客观事实,2.“二查”“反应条件”“连接符号”“↑”“↓”是否使用恰当,3.“三查”拆分是否正确,4.“四查”是否“漏写”离子反应,5.“五查”是否符合三个守恒(1)质量守恒(2)电荷守恒(3)得失电子守恒,6.“六查”是否符合离子配比,7.“七查”反应物的“量”——过量、少量、足量等。A、氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu,正确;B、稀 H2SO4与铁粉反应生成硫酸亚铁和氢气,不符合客观事实,错误;C、氢氧化钡溶液与稀 H2SO4反应:Ba2++SO42-=BaSO4↓,漏掉氢离子与氢氧根生成水的反应,错误;D、碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑,碳酸钙为难溶物,应用化学式表示,错误。 本题难度:一般 3、填空题 (10分)某海域海水一些化学成分如下表
某化学小组同学欲在实验制备MgCl2,并提取Zn。设计流程如下: 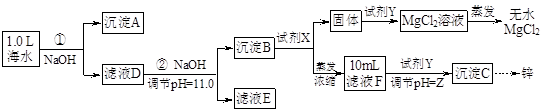 [假设①②过程溶液体积不变,忽略分离过程的损失] (1)25℃时测得海水的pH为8.0,其原因是(写离子方程式) 。 (2)下图为溶液pH与对应的Zn2+、[Zn(OH)4]2-物质的量浓度的对数坐标图。 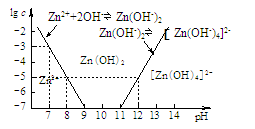 请结合图中数据回答: 试剂X的化学式为 ;由滤液F到沉淀C过程(一般认为离子浓度低于10-5mol/L就是沉淀完全),则调节的pH的范围为 。 (3)同学们发现,把MgCl2溶液蒸发、灼烧所得的白色固体难溶解于水,于是认为其主要成分是MgO。你认为 (填“正确”、“不正确”),原因是(用化学方程式表示) 、 。 (4)由图中c(Zn2+)计算Zn(OH)2的溶度积Ksp= 。 参考答案:(1)HCO3-+H2O?H2CO3+OH- 本题解析:(1)海水中的成分是弱酸的酸式酸根离子,水解使溶液呈碱性:HCO3-+H2O?H2CO3+OH-;(2)海水在①加入NaOH使转化为碳酸根离子与钙离子反应产生沉淀A碳酸钙,滤液D继续加入NaOH至PH=11.0,产生沉淀B,成分为氢氧化锌和氢氧化镁,沉淀B继续加入NaOH将氢氧化锌溶解,而氢氧化镁不溶,从而分离,根据浓度对数一PH图表可知:由滤液F到沉淀C过程,将锌离子转化为氢氧化锌沉淀的PH范围为9-11,一般认为离子浓度低于10-5mol/L就是沉淀完全,由c(Zn2+)=10-5mol/L,lgc=-5,PH=8,c([ Zn(OH-)4]2-)=10-5mol/L,lgc=-5,PH=12,故应调节的pH的范围为8-12;(3)MgCl2是强酸弱碱盐,水解MgCl2+2H2O?Mg(OH)2+2HCl,加热使水解程度增大而产生氢氧化镁,同时产生的盐酸易挥发使平衡正向移动,最终产生的氢氧化镁沉淀灼烧分解产生氧化镁和水,涉及的反应为:MgCl2+2H2O 本题难度:困难 4、选择题 下列离子方程式书写正确的是 |
参考答案:C
本题解析:A中电荷没有配平,错;B中碳酸钙是难溶物,不能写成离子形式,错;D中H ClO是弱酸,要写成化学式,D错。
考点:离子方程式的正误判断。
本题难度:一般
5、选择题 下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是
A.CuCl2+NaOH;CuSO4+NH3·H2O
B.KHCO3+HNO3;K2CO3+HNO3
C.NaHCO3+ H2SO4; Ba(HCO3)2+ H2SO4
D.Ba(OH)2+HCl;KOH+H2SO4
参考答案:D
本题解析:A项CuCl2+2NaOH的离子方程式为:Cu2++2OH-= Cu(OH)2↓,CuSO4+2NH3·H2O的离子方程式为:Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+,A错误;KHCO3+HNO3的离子方程式为:HCO3-+ H+= H2O+ CO2↑K2CO3+2HNO3的离子方程式为:CO32- +2 H+= H2O+ CO2↑B错误;NaHCO3+ H2SO4的离子方程式为:HCO3-+ H+= H2O+ CO2↑, Ba(HCO3)2+ H2SO4的离子方程式为:2HCO3-+ 2H++ Ba2++SO42-= 2H2O+2CO2↑+Ba SO4, C错误;Ba(OH)2+HCl的离子方程式为:H+ + OH-= H2O,KOH+H2SO4的离子方程式为:H+ + OH-= H2O,D正确。
考点:离子方程式的书写
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《反应速率与.. | |