微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 氯的含氧酸根离子有ClO-、ClO2-、ClO3-、ClO4-等,有关它们的下列说法正确的是
A.ClO-中氯元素显+1价,具有很强还原性
B.这些离子结合H+的能力,ClO4-最强
C.这些离子中的氯原子都采取sp3杂化
D.ClO3-是NO3-的等电子体,其空间构型为平面三角形
参考答案:C
本题解析:ClO-中氯元素显+1价,但具有很强的氧化性,A不正确;酸性越弱,相应的酸根越容易结合氢离子,这些离子结合H+的能力,ClO-最强,B不正确;价电子数和原子数分别都相等的是等电子体,所以ClO3-不是NO3-的等电子体,其空间构型为三角锥形结构,D不正确,答案选C。
点评:该题是中等难度的试题,主要是考查学生对对酸性强弱、杂化轨道类型以及分子空间结构的熟悉了解程度,有利于培养学生分析、归纳和总结问题的能力。
本题难度:一般
2、选择题 氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1 mol H2中的化学键消耗的能量为Q1kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2KJ,形成1 mol HCl中的化学键释放的能量为Q3kJ。下列关系式中正确的是
[? ]
A.Ql+Q2>Q3
B.Q1+Q2>2Q3
C.Ql +Q2< Q3
D.Q1+Q2 <2Q3
参考答案:D
本题解析:
本题难度:一般
3、计算题 100L水煤气燃烧后共放出热量1143.3kJ。
CO(g)+1/2 O2(g)=CO2(g);△H=-282.85kJ
H2(g)+1/2 O2(g)=H2O(l);△H=-285.8kJ
该水煤气是由H2、N2、CO和CO2组成的混合气体。通入60LO2中燃烧后得到65L气体,再与NaOH溶液振荡后体积变为20L(以上体积均在标准状况下测定)。这种水煤气中各种气体的体积是多少?
参考答案:100L这种水煤气中含H250L、CO40L、CO25L、N25L。
本题解析:本题应抓住3个关键:一是热效应,4种气体中能燃烧的是H2和CO,二者燃烧放出的热量是1143.3kj;二是燃烧后气体体积的变化,可知CO和H2燃烧后,气体的体积均减少;三是被NaOH溶液吸收的是CO2。而CO2的来源有二,其一是原来的,其二是由CO燃烧生成的。
---设100L水煤气中有H2xL,CO为yL。由反应热可知:
CO(g)+1/2 O2(g)=CO2(g);△H="-282.85kj/mol"
1mol 282.85kj
yL/(22.4L/mol) m
m="y/22.4" ×282.85kj
H2(g)+1/2 O(g)=H[sub]2O(l);△H=-285.8kj/mol
1mol 285.8kj
xL/(22.4L/mol) n
n="x/22.4" ×285.8kj
故得:y/22.4 ×282.85+x/22.4 ×285.8="1143.3…………①"
由体积关系有:
CO(g)+1/2 O2(g)=CO2(g) △V
1 1/2 1 0.5
y 0.5y
H2(g)+1/2 O2(g)=H2O(g) △V
1 1/2 1.5
故得1.5x+y="100+60-65……………②"
联立①②,解得x=50(L),y="40(L)"
NaOH吸收CO2的体积为40L,所以原煤气中CO2的体积为45L-40L=5L,N2的体积为100-40-5=5L。
本题难度:简单
4、选择题 下列各项表述与示意图一致的是
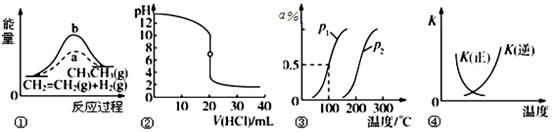
A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) →CH3CH3(g) +ΔQ ,0<ΔQ;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ
CO(g)+3H2(g) +ΔQ ,反应CH4的转化率与温度、压强的关系,且p1>p2、0<ΔQ
D.图④中曲线表示反应2SO2(g)+O2(g)  2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化
2SO3(g) +ΔQ ,0<ΔQ;正、逆反应的平衡常数K随温度的变化