微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。

A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1
B.反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH<0
CH3OH(g)+H2O(g)的ΔH<0
C.在T2℃时,若反应处于状态D,则一定有v正<v逆
D.若T1℃、T2℃时的平衡常数分别为K1、K2,则K1>K2
参考答案:C
本题解析:由反应方程式可知,5 min后CO2转化了0.4 mol,则0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1,A正确。从图像可以看出,温度升高,c(CO2)增大,说明正反应是放热反应,B正确。在T2℃时,若反应处于状态B,则是平衡状态,由D→B反应正向进行,一定有v正>v逆,C错误。因为该正反应的ΔH<0,所以温度升高时平衡逆向移动,平衡常数减小,故K1>K2,D正确。
本题难度:一般
2、填空题 (5分)(1)G.H.盖斯,根据一系列事实于1840年提出“不管化学过程是一步或分数步完成,这一过程热效应相同”。换言之,若一个反应可分成几步反应完成,则各步反应的反应热总和与该反应一次发生时反应热相同。应用这个原理,解决下列问题:
已知:①C(s)+O2(g)==CO2(g) ?H=" -393.5kJ/mol②CO(g)+1/2" O2(g)==CO2(g) ?H= -283kJ/mol
写出C(s)与O2(g)反应生成CO(g)的热化学方程式:___________________________________
(2)反应:2A(气) B(气)+xC(气),在一定的条件下达到平衡状态,密闭容器中的压强增大P%,测得A的转化率为P%,,则x的值为_____.
B(气)+xC(气),在一定的条件下达到平衡状态,密闭容器中的压强增大P%,测得A的转化率为P%,,则x的值为_____.
参考答案:21、(5分)(1) C(s)+1/2O2(g)=CO(g) ?H= -110.5kJ/mol(2)X=3
本题解析:(1)根据盖斯定律,①-②可得,C(s)与O2(g)反应生成CO(g)的热化学方程式为C(s)+1/2O2(g)=CO(g) ?H= -110.5kJ/mol;
(2)2A(气)  B(气) + xC(气)
B(气) + xC(气)
开始浓度 a 0 0
转化浓度 a?P% 0.5a a?P% 0.5x a?P%
平衡浓度a- a?P% 0.5a a?P% 0.5x a?P%
(a- a?P% + 0.5a a?P% +0.5x a?P%)÷a="(1+" P%)÷1 解得x=3
考点:考查盖斯定律的应用,化学平衡的计算。
本题难度:一般
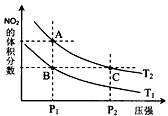
3、选择题 反应N2O4(g)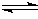 2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g);△H= +57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
[? ]
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
参考答案:C
本题解析:
本题难度:一般
4、选择题 一定温度下,在一个固定容积的密闭容器中加入1molH2和3 molN2,建立如下平衡: N2(g)+3H2(g)?2NH3(g)相同条件下,若向容器中再通入1 mol H2和,3 molN2再次达到平衡.则下列说法正确的是( )
A.NH3的百分含量不变
B.N2的体积分数增大
C.N2的转化率增大
D.NH3的百分含量增小