| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《影响化学反应速率的因素》高频考点预测(2017年最新版)(六)
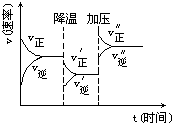 参考答案:由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热,则A、C错误; 本题解析: 本题难度:简单 5、填空题 某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,标况下用排水集气法收集反应放出的氢气,实验记录如下(累计值) 参考答案:(1)2~3min;因该反应是放热反应,2~3min时温度高 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《化学平衡状.. | |