微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在可逆反应中,改变下列条件一定能加快反应速率的是
[? ]
A.增大反应物的量
B.升高温度
C.增大压强
D.使用催化剂
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法正确的是:(?)
A.仅含有Na+、H+、OH—、CH3COO—四种离子的某溶液中可能存在:
c(Na+)>c(OH—)>c(CH3COO—)>c(H+)
B.铝热法炼铁过程中镁条和氯酸钾起催化作用
C.二氧化硫的催化氧化是放热反应,升高温度可以减慢该反应的速率
D.人体内淀粉、脂肪、蛋白质的水解都是由酶所催化的
参考答案:AD
本题解析:略
本题难度:简单
3、选择题 温度700℃ 时,向容积为2L的密闭容器中充入一定量的CO和H2O发生反应
CO(g)+H2O(g)  CO2(g)+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
CO2(g)+H2(g) ,反应过程中测定的部分数据见下表(表中t1<t2)。
反应时间/min
| n(CO)/mol
| n(H2O)/ mol
|
0
| 1.20
| 0.60
|
t1
| 0.80
|
|
t2
|
| 0.20
|
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
C.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
D.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.40 mol
参考答案:D
本题解析:A、根据表中数据分析,在t1min时,一氧化碳的物质的量为0.8摩尔时,反应了1.2-0.8=0.4摩尔,故生成氢气0.4摩尔,所以氢气的平均速率=(0.4÷2)/ t1="0.2/" t1,故不选A;B、根据表中数据分析t2时,一氧化碳的物质的量为0.8摩尔,说明反应达到了平衡,故该温度下,平衡常数=(0.4×0.4)÷(0.8×0.2)=1,当再通入0.2摩尔水蒸汽时,平衡正向移动,一氧化碳的转化率增大,设反应的水蒸汽的物质的量为x,则
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量 0.8 0.4 0.4 0.4
改变的物质的量x x x x
平衡时物质的量0.8-x 0.4-x 0.4+x 0.4+x
列式:(0.4+x)×(0.4+x)÷[(0.8-x)×(0.4-x)]=1 x=0.08mol,故平衡时水的体积分数= (04-0.08)/2=16%,原平衡时水的体积分数=0.2/1.8=11.1%。故水的体积分数增大,故不选B;C、升温化学平衡常数由1变化到0.64,减小,说明平衡逆向移动,正反应为放热反应,故不选C;D、
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
起始物质的量 0.6 1.2 0 0
改变的物质的量x x x x
平衡时物质的量0.6-x 1.2-x x x
列式: x×x÷[(0.6-x)×(1.2-x)]=1 x=0.4mol,故平衡时二氧化碳的物质的量为0.4摩尔,故选D。
考点:化学平衡的计算,化学平衡常数。
本题难度:一般
4、选择题 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)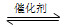 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
参考答案:D
本题解析:该反应中S为液态,反应前后气体的物质的量改变,在恒容容器中进行该反应,平衡前随着反应的进行压强一直在改变,A项错误;反应中S为液态,其量的变化不影响反应速率,B项错误;该反应的正反应是放热反应,升温后平衡逆向移动,SO2的转化率减小,C项错误;平衡常数只与温度有关,催化剂不能改变反应物的转化率,平衡常数不变,D项正确。
本题难度:一般
5、选择题 一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g),根据题意,以下说法正确的是
CH3OH(g),根据题意,以下说法正确的是
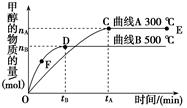
A.E点的平衡常数大于D点的平衡常数,且该反应的ΔH <0
B.容器中气体的总物质的量E点大于D点
C.当容器内气体密度不变时,说明该反应已达到平衡状态
D.v(甲醇)=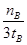 mol/(L·min)-1表示500 ℃以上反应在D点的速率
mol/(L·min)-1表示500 ℃以上反应在D点的速率
参考答案:A
本题解析:A、平衡后300℃时甲醇物质的量大于500℃时甲醇物质的量,所以正反应为放热反应,ΔH <0,E点的平衡常数大于D点的平衡常数,正确;B、该反应的反应前后物质的量为减小趋势,所以生成甲醇越多,总物质的量越小,则D点的总物质的量大于E点,错误;C、根据质量守恒定律,气体的质量不变,而密闭容器的体积恒定,不论反应是否平衡,容器内气体密度不变,所以当容器内气体密度不变时,不能说明该反应已达到平衡状态,错误;D、v(甲醇)=mol/(L·min)-1表示在500℃时,从开始到tB时间内的平均速率,而不是D点的瞬时速率,错误。
本题难度:一般