微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。下列关于上述实验现象的解释不正确的是
[? ]
A.铝在空气中能很快形成氧化膜
B.铝箔表面温度低,未熔化
C.氧化铝的熔点比铝高
D.氧化铝薄膜包住了熔化的铝
参考答案:B
本题解析:
本题难度:一般
2、填空题 某研究小组将一批废弃的线路板经浓硝酸和稀硫酸处理后得到一混合溶液,其中含有Cu2+、Fe2+、Fe3+、Al3+等金属离子,并设计了以下两种流程以分别制取CuSO4·5H2O晶体和AlCl3
溶液:
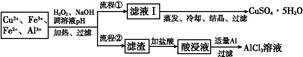
已知:相关金属离子开始沉淀至完全沉淀时的pH范围为:
离子
| Fe3+
| Fe2+
| Al3+
| Cu2+
|
pH范围
| 2.2~3.2
| 5.5~9.0
| 4.1~5.0
| 5.3~6.6
|
请回答下列问题:
(1)加入H2O2的作用是 ?,欲使制取的CuSO4·5H2O晶体较为纯净,pH至少应调至 。
(2)写出H2O2与Fe2+反应的离子方程式:?。
(3)流程②中加入适量Al粉起的作用是? 。
(4)根据你所学的化学知识,由AlCl3溶液(不添加其他化学试剂)能否制得无水AlCl3 (填“能”或“不能”),原因是 ?。
(5)取体积为V(L)的酸浸液,向其中滴加a mol·L-1的NaOH溶液,生成沉淀的物质的量与所加的NaOH溶液的体积(L)关系如图。请用V1、V2、V3表示所取的酸浸液中n(Fe3+)∶n(Al3+)= ?。

参考答案:(1)将Fe2+氧化为Fe3+ 5.0
(2)2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
(3)与酸浸液中Fe3+和H+反应生成Al3+
(4)不能 直接加热AlCl3溶液,会发生水解反应,最终得到氧化铝 (5)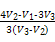
本题解析:(1)由相关金属离子沉淀,pH范围图表可知:Fe2+与Cu2+沉淀pH范围存在交叉,不易除去,故加入H2O2将Fe2+氧化为Fe3+,可避免这一问题,并且调节pH为5.0,可以将Al3+与Fe3+同时除去。
(2)H2O2与Fe2+反应的离子方程式为:H2O2+2Fe2++2H+ 2Fe3++2H2O。
2Fe3++2H2O。
(3)由流程图可知,滤渣是Fe(OH)3与Al(OH)3的混合物,加盐酸溶解后得到的是含FeCl3、AlCl3、HCl的混合物,为了得到较纯的AlCl3溶液,加入适量Al可以将FeCl3与HCl反应掉。
(4)AlCl3溶液中存在水解平衡:AlCl3+3H2O Al(OH)3+3HCl,加热蒸发时,HCl会挥发造成平衡右移,最终得不到AlCl3。
Al(OH)3+3HCl,加热蒸发时,HCl会挥发造成平衡右移,最终得不到AlCl3。
(5)NaOH溶液的物质的量浓度为a,据图像可知:
V1~V2段发生反应为:
Al3++3OH- Al(OH)3↓,
Al(OH)3↓,
Fe3++3OH- Fe(OH)3↓;
Fe(OH)3↓;
V2~V3段发生反应为:
Al(OH)3+OH- Al
Al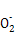 +2H2O,
+2H2O,
据此可求出n(Al3+)=a(V3-V2),
n(Fe3+)=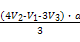 ,
,
故n(Fe3+)∶n(Al3+)=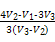 。
。
本题难度:困难
3、选择题 Fe2O3和Al2O3都
A.是两性氧化物
B.可与氢氧化钠溶液反应
C.可与盐酸反应
D.可溶于水
参考答案:C
本题解析:Fe2O3是碱性氧化物,能和盐酸反应,不溶于水,不能与氢氧化钠溶液反应,Al2O3是两性氧化物,既能和盐酸反应,也能与氢氧化钠溶液反应,但也不溶于水,故C选项正确。
本题难度:简单
4、选择题 当光束通过下列分散系时,能观察到丁达尔效应的是
A.蔗糖溶液
B.盐酸
C.氯化钠溶液
D.Fe(OH)3胶体
参考答案:D
本题解析:分析:丁达尔效应的是胶体特有的性质,所以只要判断下列分散系是胶体即可.
解答:胶体粒子的微粒直径在1-100nm之间,分散质微粒直径小于1-100nm的是溶液,大于1-100nm的是浊液;
A、B、C是溶液,D是胶体.
故选D.
点评:胶体的本质特征是:胶体粒子的微粒直径在1-100nm之间,这也是胶体与其它分散系的本质区别.
本题难度:简单
5、填空题 A.《物质结构与性质》
(1)前三周期元素中第一电离能最小的是? _______?(填元素符号),其基态原子的电子排布式为? _______?。第二周期非金属元素形成的氢化物中化学键极性最大的是? _______?
(填分子式),该物质在CCl4中的溶解度比在水中的溶解度? _______?(填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是? _______?(填物质字母代号)。
(3)晶格能的大小:MgO? _______?NaCl,键能的大小:HBr? _______?HI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是? _______?
A.金刚石>晶体硅>二氧化硅>碳化硅
B.CI4 > CBr4 > CCl4 > CH4
C.SiF4 > NaF > NaCl > NaBr
B《实验化学》
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1?部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Mg(OH)2
|
pH值
| 5.2
| 3.2
| 9.7
| 10.4
| 11.2
|
表2?两种盐的溶解度(单位为g/100g水)
温度 / ℃
| 10
| 30
| 40
| 50
| 60
|
CaSO4
| 0.19
| 0.21
| 0.21
| 0.20
| 0.19
|
MgSO4·7H2O
| 30.9
| 35.5
| 40.8
| 45.6
| /
|
硼镁泥制取七水硫酸镁的工艺流程如下:
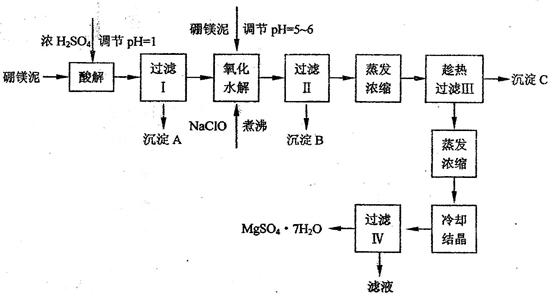
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为? _______?。加热煮沸的主要目的是_? _______?。
(2)沉淀B中除MnO2、SiO2外还含有? _______?(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是? _______?;
(4)沉淀C的化学式是? _______?。过滤II需趁热过滤的理由是? _______?
参考答案:A、(1)Na? 1S22S22P63S1? HF?小?
(2)B?
(3)>? >?
(4)B?
B、
(1)Mn2++ClO-+H2O=MnO2↓+2H++Cl-; 促进Al3+、Fe3+水解及Mn2+氧化成MnO2
(2)Fe(OH)3、 Al(OH)3
(3)取过滤II后的滤液1~2 ml于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+
(4)CaSO4·2H2O或CaSO4; 以防MgSO4在温度低时结晶析出。
本题解析:A (2)B的熔沸点明显高于A,且水中溶解度也大于A。(3)MgO的离子所带电量都大于NaCl,而离子半径又小于NaCl,所以离子键强度大于NaCl,晶格能大。HBr键长比HI短,键能大。
本题难度:一般