|
高考化学知识点总结《阿伏伽德罗常数》高频考点预测(2017年最新版)(四)
2017-08-08 04:26:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关阿伏加德罗常数说法正确的是(NA表示阿伏加德罗常数的值)
A.常温常压下,18g NH4+所含的电子数为10NA
B.56g金属铁与氯气反应时得到的电子数为3NA
C.标准状态下,22.4L氧气所含的氧原子数为2 NA
D.4.48 L H2和O2的混合气体中所含分子数约为0.2 NA
|
参考答案:AC
本题解析:18g NH4+物质的量为1mol,18g NH4+中有10个电子,电子的物质的量为10mol,个数为10NA,A对;金属铁与氯气反应时铁做还原剂,失去电子,B错;标准状态下,22.4L氧气的物质的量为1mol,氧原子的物质的量为2mol,个数为2 NA,C对;D中没有标准状况条件无法计算,选AC。
考点:阿佛加德罗常数的有关计算。
本题难度:一般
2、选择题 已知1g?N2含有m个原子,则阿伏加德罗常数为
A.
B.14mmol-1
C.28m
D.28mmol-1
参考答案:B
本题解析:分析:每摩尔微粒含有阿伏伽德罗常数个微粒,据此计算1mol氮气含有的氮气分子,根据N=n×NA来计算阿伏伽德罗常数,注意其单位为mol-1
解答:1mol氮气的质量为1mol×28g/mol=28g.
由于1g?N2含有m个原子,所以含有的氮气分子数为0.5m,
所以28g含有的氮气分子数为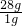 ×0.5m=14m, ×0.5m=14m,
即1mol氮气含有14m个氮气分子,
所以14m=1mol×NA,解得NA=14mmol-1,
故选:B.
点评:考查学生对阿伏伽德罗常数的理解,难度不大,注意阿伏伽德罗常数单位为mol-1.
本题难度:一般
3、选择题 下列数量的各物质所含的原子数按由大到小顺序排列正确的是( )
①0.5molNH3②标准状况下22.4L氦气(He)?③4℃时9mL水?④0.2molNa3PO4.
A.①③④②
B.①④③②
C.④③②①
D.②③④①
参考答案:①0.5molNH3的原子数为0.5×4NA=2NA,
②标准状况下22.4L氦气的原子数为22.4L22.4L/mol×NA/mol=NA,
③4℃时9mL水的质量为9g,原子数为9g18g/mol×3×NA/mol=1.5NA,
④0.2molNa3PO4的原子数为0.2×8NA=1.6NA,
由大到小顺序排列顺序为:①④③②.
故选B.
本题解析:
本题难度:一般
4、选择题 以NA?表示阿伏加德罗常数,下列说法正确的是( )
A.T℃时,1?L?pH=6纯水中,含10-8NA个OH-
B.15.6?g?Na2O2?与过量CO2反应时,转移的电子数为0.4NA
C.1?mol?SiO2中含有2?mol?Si-O单键
D.14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n
参考答案:A、1?L?pH=6纯水中,含10-6NA个OH-,故A错误;
B、15.6gNa2O2?物质的量为0.2mol,与过量CO2反应时,过氧化钠自身氧化还原反应,转移的电子数为0.2NA,故B错误;
C、1?molSiO2中含有4molSi-O单键,故C错误;
D、依据通式判断链烃中含有一个双键,14g分子式为CnH2n物质的量=14g14ng/mol=1nmol,链烃中含有的C=C的数目一定为NA/n,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.1molSiO2晶体内含有2NA个Si-O键
B.在0.1mol熔融KHSO4中,含有0.1NA个SO42-
C.在0.5L1mol?L-1的盐酸中所含粒子总数为NA
D.46g四氧化二氮和二氧化氮的混合气体中含有原子数为3NA
参考答案:A、1molSiO2晶体内含有4NA个Si-O键,故A错误;
B、在0.1mol熔融KHSO4中,含有0.1NA个HSO4-,故B错误;
C、0.5L1mol?L-1的盐酸中所含粒子总数还包括水中的分子和离子,所以粒子总数大于NA,故C错误;
D、四氧化二氮和二氧化氮的最简比相同,混合气体中含有原子数可以依据46gNO2中的原子数计算,所含原子数=46g46g/mol×3×NA=3NA;故D正确;
故选D.
本题解析:
本题难度:一般
|