微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于电解KNO3溶液时的叙述正确的是
A. 向阴极移动,K+向阳极移动,分别在对应的极上析出
向阴极移动,K+向阳极移动,分别在对应的极上析出
B.随电解的进行,溶液的pH减小
C.OH-向阳极移动,阳极附近溶液显碱性
D.阴极上H+得电子被还原成H2,促进水的电离平衡正向移动,富集下来的OH-使得阴极附近溶液呈碱性
参考答案:D
本题解析:根据电解原理,溶液中的阴离子 、OH-定向向阳极移动后,OH-失电子被氧化生成O2,因而阳极区OH-浓度迅速减小,使得c(H+)>c(OH-),故阳极附近溶液显酸性;另溶液中的阳离子K+、H+定向向阴极移动后,H+得电子生成H2,因而使得阴极区H+浓度迅速减小,使得c(OH-)>c(H+),故阴极附近溶液显碱性。
、OH-定向向阳极移动后,OH-失电子被氧化生成O2,因而阳极区OH-浓度迅速减小,使得c(H+)>c(OH-),故阳极附近溶液显酸性;另溶液中的阳离子K+、H+定向向阴极移动后,H+得电子生成H2,因而使得阴极区H+浓度迅速减小,使得c(OH-)>c(H+),故阴极附近溶液显碱性。
本题难度:简单
2、选择题 用两支惰性电极插入250mlCuSO4溶液中,通电电解。当电解液的pH从6.0变为2.0时(电解时阴极没有氢气放出,且电解液在前后体积变化可以忽略),则阴极增重( )
A.80mg
B.160mg
C.320mg
D.640mg
参考答案:A
本题解析:电解液中生成的H+的物质的量为:(10-2—10-6)× 0.25=2.5×10-3mol
由电解反应式2CuSO4+2H2O 2Cu+O2↑+2H2SO4可知阴极铜的质量为80mg
2Cu+O2↑+2H2SO4可知阴极铜的质量为80mg
故答案为A
本题难度:一般
3、选择题 关于如图所示装置的叙述正确的是
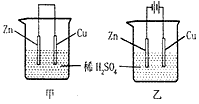
[? ]
A.甲乙装置中的锌片都作负极
B.甲乙装置中的溶液内的H+都是在铜片上被还原
C.甲乙装置中锌片上发生的反应都是还原反应
D.甲装置中铜片上有气泡生成,乙装置中的铜片质量减小
参考答案:D
本题解析:
本题难度:一般
4、选择题 工业上由二氧化锰制备高锰酸钾可分二步进行,第一步二氧化锰与氢氧化钾共熔并通入氧气2MnO2 + 4KOH +O2  ?2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:
?2K2MnO4 +2H2O;第二步:电解锰酸钾溶液:
2K2MnO4 +H2O  2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
2KMnO4 +H2↑ +2 KOH 下列说法叙述正确的是
A.氧化性:KMnO4>K2MnO4 >O2
B.根据上述过程,每生成1molKMnO4共转移6mol电子
C.第二步电解时阴极周围pH减小
D.第二步电解时,KMnO4在阳极区生成
参考答案:D
本题解析:A项:应为氧化性:KMnO4>O2>K2MnO4,故错;B项:生成1molKMnO4共转移3mol电子,故错;C项:有碱生成,PH增大,故错。故选D。
点评:本题考查的是氧化还原反应和电解原理的应用的相关知识,题目难度中等,注意基础知识的学习。
本题难度:简单
5、填空题 如下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
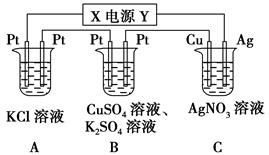
(1)电源电极X的名称为________。
(2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH-的物质的量浓度为________(设电解前后溶液体积无变化)。
参考答案:(1)负极 (2)增大 减小 不变 (3)0.025 mol·L-1 (4)0.1 mol·L-1
本题解析:(1)C装置的铜电极质量增加,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,故铜极为阴极,由此可确定X极为负极。(2)A装置是电解KCl溶液,阴极析出氢气,阳极析出氯气,溶液中氢氧根离子浓度增大,B装置中阴极上先析出铜,当铜离子消耗完后将析出氢气,而阳极上析出氧气,溶液中氢离子浓度增大,C装置中阴极析出银单质,阳极上的银失去电子变成银离子,理论上AgNO3溶液的物质的量浓度不变。(3)B装置两极上电子转移的数目与C装置中转移的电子数目相同,C装置中转移的电子为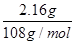 =0.02 mol,经判断,B装置中阴极:Cu2++2e-=Cu,2H++2e-=H2↑,阳极:4OH--4e-=O2↑+2H2O,根据题意可得:2n(H2)+2n(Cu)=4n(O2)=0.02 mol,n(H2)+n(O2)=
=0.02 mol,经判断,B装置中阴极:Cu2++2e-=Cu,2H++2e-=H2↑,阳极:4OH--4e-=O2↑+2H2O,根据题意可得:2n(H2)+2n(Cu)=4n(O2)=0.02 mol,n(H2)+n(O2)=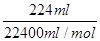 ,解得n(Cu)=0.005 mol,CuSO4溶液物质的量浓度为:
,解得n(Cu)=0.005 mol,CuSO4溶液物质的量浓度为: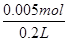 =0.025 mol·L-1。(4)A装置的反应为:2KCl+2H2O
=0.025 mol·L-1。(4)A装置的反应为:2KCl+2H2O 2KOH+H2↑+Cl2↑,即反应中电子转移的物质的量与生成的氢氧根离子的物质的量相等,为0.02 mol,c(OH-)=
2KOH+H2↑+Cl2↑,即反应中电子转移的物质的量与生成的氢氧根离子的物质的量相等,为0.02 mol,c(OH-)=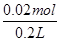 =0.1 mol·L-1
=0.1 mol·L-1
本题难度:一般