| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《影响化学反应速率的因素》答题技巧(2017年最新版)(六)
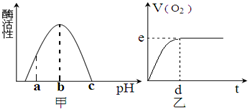 参考答案:A、温度升至100℃酶基本失去活性,H2O2分解速率减慢,但整个过程产生的O2的体积恒定,即e点不移,d点右移,故A正确; 本题解析: 本题难度:简单 2、选择题 甲:在试管中加入1 g粉末状大理石,加入4 mol/L盐酸20 mL(过量); 参考答案:D 本题解析:碳酸钙的表面积越大,和盐酸反应的反应速率就越大,据此可知甲中反应速率快,但生成的CO2体积小于乙中,所以答案选D。 本题难度:简单 3、填空题 室温下,水溶液体系中的化学反应I— + OCl— = OI— + Cl—的反应物初始浓度、溶液中的OH—初始浓度及初始速率间的关系如下表所示:
 知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [OCl—]b [OH—]c(温度一定时,k为常数)。 知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—?]1 [OCl—]b [OH—]c(温度一定时,k为常数)。(1)为开展实验1,某同学取5mL0.02mol·L-1碘化钾溶液、5mL0.015 mol·L-1次氯酸钠溶液、40mL某浓度氢氧化钠溶液混合反应。则该氢氧化钠溶液物质的量浓度为?; (2)实验2中,a="?" ; (3)设计实验2和实验4的目的是?; (4)计算b、c值:b="?" ;c  = ?; = ?;(5)若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v="?" 。 参考答案: 本题解析:略 本题难度:简单 4、填空题 (12分)2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。 |
参考答案:
本题解析:
本题难度:困难
5、选择题 足量的锌与酸反应,欲使制取氢气的反应速率尽可能大,选用的反应条件正确的组合是
①锌粒?②锌粉?③加少量的硫酸银的饱和溶液?④1mol/L的盐酸 ⑤5mol/L的硝酸
⑥1mol/L的硫酸?⑦加热 ⑧加大量的硫酸铜晶体?⑨不断振荡?⑩加大体系的压强
A.②③⑥⑦⑨
B.①③⑤⑦⑩
C.②④⑥⑦⑧⑨
D.②⑦⑧⑨⑩
参考答案:A
本题解析:影响反应速率的因素一般有温度、浓度、压强、催化剂以及反应物的接触面积,据此可以判断。锌粒相对于锌粉,锌粉的接触面积大,反应速率快。加少量的硫酸银的饱和溶液,锌可以置换出银从而构成原电池加快反应速率;硫酸是二元强酸,盐酸是一元强酸,在浓度相等的条件下硫酸反应速率快,所以选择1mol/L的硫酸。硝酸是氧化性酸,与金属反应得不到氢气。加热温度升高,反应速率加快。加大量的硫酸铜晶体后锌只与硫酸铜发生置换反应,得不到氢气。不断震荡可以增大反应物的接触面积,加快反应速率。反应物中没有气体参与,增大压强反应速率不变,因此正确的组合是②③⑥⑦⑨,答案选A。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《氧化还原、.. | |