微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用惰性电极电解50 mL锰酸钾溶液:K2MnO4+H2O→KMnO4+H2↑+KOH(未配平),当生成112 mL氢气(标准状况)时停止通电。下列判断正确的是 (?)
A.K+浓度减小
B.KMnO4在阳极区生成
C.阴极周围溶液的pH减小
D.反应过程中共转移0.005mol电子
参考答案:B
本题解析:A.反应方程式为:2K2MnO4+2H2O=2KMnO4+H2↑+2KOH。在反应过程中K+没有发生反应,所以浓度,消耗了水,所以K+的浓度增大。错误。B. MnO42-→MnO4-.失去电子,发生氧化反应。根据电解原理:阳极发生氧化反应,阴极发生还原反应。所以KMnO4在阳极区生成。正确。C.阴极放出氢气,破坏了附近的水的电离平衡,导致附近溶液中的OH-的浓度增大,周围溶液的pH增大。错误。在反应中每产生1mol的氢气转移电子2mol.现在产生氢气n(H2)=0.112L÷22.4mol/L=0.005mol.所以转移电子0.01mol.错误。
本题难度:一般
2、选择题 某混合溶液中只含有两种溶质NaCl和CuSO4,且n(NaCl):n(CuSO4)=3:2.若以石墨电极电解该溶液,下列推断中不正确的是( )
A.整个电解过程,最后电解的是水
B.阳极先析出Cl2,后析出O2
C.整个电解过程分三个阶段,第二阶段电解的是硫酸铜和水
D.阴极自始至终只析出铜
参考答案:A、电解质可以将溶质看成3molNaCl和2molCuSO4,开始阶段,阴极上是铜离子得电子,阳极上是氯离子失电子,电解氯化铜阶段,当氯离子电解完毕后,阳极上是氢氧根离子失电子,阴极上是铜离子在得电子,随后是氢离子得电子,电解的最后是电解水,故A正确;
B、根据A的分析可知阳极上是氯离子先失电子,随后是氢氧根离子失电子,即先析出Cl2,后析出O2,故B正确;
C、整个电解过程分三个阶段,第一阶段电解氯化铜,第二阶段电解的是硫酸铜和水第三阶段是电解水,故C正确;
D、阴极开始析出金属铜,随后生成的是氢气,故D错误.
故选D.
本题解析:
本题难度:简单
3、选择题 用惰性电极电解CuCl2和CuSO4混合溶液(浓度均为0.01摩/升)500毫升,当阴极析出0.48克Cu时,在标准状况下,阳极可得到的气体约为?
A.0.168升
B.0.14升
C.0.336升
D.0.24升
参考答案:B
本题解析:惰性电极电解CuCl2与CuSO4的混合溶液,阴极析出Cu,阳极先是2Cl--2e=Cl2,然后若还有电子转移,应为4OH--4e=2H2O+O2
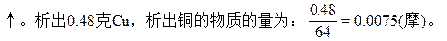
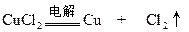
0.01×0.5? 0.005? 0.005
=0.005
0.0075-0.005? 0.00125
=0.0025
∴阳极的气体V=(0.005+0.00125)×22.4=0.14(升)
本题难度:一般
4、选择题 将纯Zn片和纯Cu片用导线连接置于同一稀H2SO4溶液中,下列各叙述中正确的是
A.Zn片上有大量气泡产生
B.负极附近C(SO42-),逐渐增大
C.正极、负极附近C(SO42-)基本不变
D.电解质溶液的pH不断减小
参考答案:B
本题解析:构成原电池:(-)Zn片:Zn-2e-=Zn2+
(+)Cu片:2H++2e-=H2↑
总反应:Zn+2H+= Zn2++ H2↑
Cu片上有大量气泡产生,故A错误;
SO42-传递负电荷,电子从负极流向正极,要形成负电荷的闭合回路,则溶液中传递负电荷的SO42-应流向负极,故B正确、C错误;
从总反应可以看出:C(H+)减小,则PH应不断增大,故D错误;
本题难度:简单
5、选择题 下列叙述错误的是
A.生铁中含有碳,抗腐蚀能力比纯铁弱
B.用锡焊接的铁质器件,焊接处易生锈
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.电解精炼铜时,电解质溶液中铜离子浓度减小