微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验中,①pH试纸的使用 ②过滤 ③蒸发?④配制一定物质的量浓度溶液,均用到的仪器是
[? ]
A.蒸发皿
B.玻璃棒?
C.试管?
D.分液漏斗
参考答案:B
本题解析:
本题难度:简单
2、填空题 (1)质量相等的HCl、CO2、NH3、CH4四种气体中,含有分子数目由多到少的顺序是______________,在相同温度和相同压强条件下,体积最大的是__________,密度最小的是_____________。
(2)在标准状况下,将________L NH3溶于水得到0.5 mol·L-1的氨水500mL;配制100mL 0.1 mol·L-1
Na2CO3溶液,需要Na2CO3·10H2O _________g。
(3)在一定温度和压强下,30体积气体A2跟10体积的气体B2化合生成20体积某气体C,则该反应的化学方程式为(气体C的化学式用A、B表示)_________________________。
参考答案:(1)CH4>NH3>HCl>CO2;CH4;CH4
(2)5.6;2.86
(3)3A2+B2==2A3B
本题解析:
本题难度:一般
3、计算题 (8分)某研究小组取一定质量的镁铝合金放入200mL稀硫酸中,固体完全溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的变化关系如图所示。
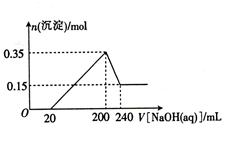
求:(1)该合金的质量
(2)原稀硫酸的物质的量浓度
参考答案:∵加入过量NaOH溶液,最终生成的沉淀只有Mg(OH)2,
故Mg(OH)2为0.15mol(1分)
∴生成的Al(OH)3最多为0.35mol-0.15mol=0.2mol(1分)
合金中含有0.15molMg和0.2molAl
合金的质量为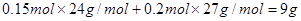 (1分)
(1分)
(2)由于加入200mL~240mLNaOH溶液时,发生反应:
NaOH+Al(OH)3=NaAlO2+2H2O
得c(NaOH)=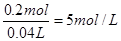 (2分)
(2分)
根据图示知:加入200mLNaOH溶液时,所得溶液中只含有Na2SO4。
溶液中含有Na2SO4: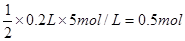 ,即SO42-为0.5mol
,即SO42-为0.5mol
所以原稀硫酸中含H2SO40.5mol(2分)
c(H2SO4)=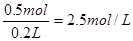 (1分)
(1分)
答:合金的质量为9g;原稀硫酸的物质的量浓度为2.5mol/L
本题解析:根据图像分析,镁铝溶于硫酸后溶液中有硫酸镁和硫酸铝和硫酸,所以先加入氢氧化钠没有沉淀生成,当氢氧化钠的体积为20毫升时开始出现氢氧化镁和氢氧化铝沉淀,沉淀最大值为0.35摩尔,然后氢氧化铝沉淀溶于氢氧化钠,最后剩余0.15摩尔氢氧化镁沉淀,所以氢氧化铝沉淀的物质的量为0.35-0.15=0.20摩尔,从而计算合金的质量。根据200到240只有氢氧化铝和氢氧化钠反应,所以可以计算氢氧化钠的物质的量或浓度,当氢氧化钠的体积为200毫升时,溶液中只有硫酸钠,所以根据硫酸钠的化学式找硫酸和氢氧化钠的关系即可计算硫酸的浓度。
考点:金属的性质,氢氧化铝的两性。
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列说法正确的是 (? )
A.1 mol Na与 O2完全反应生成Na2O或Na2O2均失去NA个电子
B.1mol Na2O2与足量CO2反应时,转移2NA个电子
C.1mol·L-1的NaOH溶液中含Na+数目为NA
D.23gNa+中含有的电子数为NA
参考答案:A
本题解析:A项:不管生成何种物质都是钠失电子,所以1 mol Na失电子数均为NA个;B项:Na2O2与足量CO2反应是Na2O2的自身岐化反应,1mol Na2O2与足量CO2反应只转移1NA个电子;C项:溶液无体积,无法计算Na+的量;D项:钠离子含有10个电子,故23gNa+中含有的电子数为10NA
本题难度:一般
5、选择题 设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 molFe2-被足量的H2O2溶液氧化,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A.3个
B.4个
C.5个
D.全部正确