微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在某密闭容器中通入a mol NO和b mol O2,发生反应:2NO+O2=2NO2,反应后容器内氮原子和氧原子之比为
A.a:b
B.a:(a+2b)
C.a:2b
D.a:2(a+b)
参考答案:B
本题解析:分析:根据原子守恒:化学反应前后原子总数不变(不管如何反应,以及反应是否完全)来回答.
解答:反应前N原子总数是amol(全部在NO中),O原子总数是(a+2b)mol(NO中有O原子,O2中也有O原子),根据原子守恒:反应后原子个数不变,所以氮原子和氧原子个数之比=a:(a+2b).
故选B.
点评:本题考查学生原子守恒思想在反应中的应用知识,较简单.
本题难度:简单
2、选择题 美国科学家将两种元素Pb和Kr的原子核对撞,获得了一种质子数为118,中子数为175的超重元素。该元素原子核内的中子数与核外电子数之差是
A.293
B.47
C.61
D.57
参考答案:D
本题解析:试题分析:质子数=核外电子数,所以该元素原子核内的中子数与核外电子数之差是=175-118=57,答案选D。
考点:考查组成原子的微粒之间数量关系的有关计算
点评:该题是高考中的常见题型,属于基础性试题的考查。重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性,难度不大。
本题难度:简单
3、选择题 欲证明一瓶无色液体是纯水,下列实验方法可行的是
A.测得其pH=7
B.跟钠反应生成氢气
C.1.01×105 Pa时沸点为100℃
D.电解时得到H2、O2,体积比为2∶1
参考答案:C
本题解析:
本题难度:简单
4、选择题 已知氯化钠的摩尔质量是58.5g/mol,密度是2.2g/ cm 3,则氯化钠晶体中相邻的钠离子核间距离的数值最接近于
A.4.0×10-8cm
B.3.5×10-8cm
C.3.0×10-8cm
D.5.0×10-8cm
参考答案:A
本题解析:摩尔质量除以阿伏加德罗常数,再除以2,得到每个氯化钠分子质量;
由于氯化钠晶体近似为正方体,每个分子质量除以密度得到每个分子体积,开3次方得到晶体边长;
由于氯化钠晶体的原子排列,钠原子间隔为根号2倍边长,于是最后算出答案为3.9*10-8,近似为4.0*10-8;
本题难度:困难
5、选择题 下列叙述正确的是
A.0.1 mol·L-1醋酸溶液中:c(H+)= c(CH3COO-)+c(OH-)
B.中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者
C.同温同浓度的NaOH和澄清石灰水中,水的电离程度相同
D.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+)
参考答案:AB
本题解析:醋酸溶液中带电离子只有H+、CH3COO-、OH-,由电荷守恒原理可知,c(H+)= c(CH3COO-)+c(OH-),故A正确;硫酸和醋酸分别是强酸、弱酸,溶质浓度相同时溶液pH:硫酸<醋酸,而溶液pH相同时溶质浓度:硫酸<<醋酸,则pH和体积都相同时溶质的物质的量:硫酸<<醋酸,则醋酸消耗NaOH的量远远大于硫酸,故B正确;NaOH、Ca(OH)2分别是一元强碱、二元强碱,同温同浓度溶液中c(OH-):NaOH<Ca(OH)2,强碱电离产生的c(OH-)越大,水的电离平衡(H2O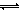 H++OH-)越向左移动,水的电离程度越小,则NaOH溶液中水的电离程度较小,故C错误;电离程度:NaHCO3>H2O,碳酸氢钠溶液呈弱碱性,说明其水解程度(HCO3-+H2O
H++OH-)越向左移动,水的电离程度越小,则NaOH溶液中水的电离程度较小,故C错误;电离程度:NaHCO3>H2O,碳酸氢钠溶液呈弱碱性,说明其水解程度(HCO3-+H2O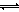 H2CO3+OH-)大于电离程度(HCO3-
H2CO3+OH-)大于电离程度(HCO3-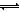 H++CO32-),由于HCO3-电离程度很小,可以忽略不计,而水的电离(H2O
H++CO32-),由于HCO3-电离程度很小,可以忽略不计,而水的电离(H2O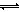 H++OH-)受到促进,则溶液中c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+),故D错误。
H++OH-)受到促进,则溶液中c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(H+),故D错误。
考点:考查水溶液中的离子平衡,包括判断稀弱酸溶液中的电荷守恒关系式、比较中和pH和体积都相同的强酸和弱酸时消耗NaOH量的大小、用化学平衡移动原理解释等浓度一元强碱和二元强碱溶液对水的电离平衡的影响、判断盐溶液中粒子浓度大小关系。
本题难度:困难