微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
参考答案:B
本题解析:A分子间作用力只决定其物理性质,稳定性是化学性质的表现,错误;冰熔化时破坏氢键和分子间作用力,错误;氯化钠熔化时破坏离子键,错误;
本题难度:一般
2、填空题 人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:?

(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的价电子排布为________.
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是________.
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液与AgNO3溶液反应得到的沉淀质量的2/3. 则绿色晶体配合物的化学式为____________________,绿色晶体中含有的化学键类型是________.
参考答案:(1)四;ⅣB;3d24s2
(2)①BaTiO3;②[TiCl(H2O)5]Cl2·H2O;共价键、配位键、离子键
本题解析:
本题难度:一般
3、填空题 硫化氢(H2S)分子中,两个H-S键的夹角接近90°,说明H2S分子的空间构型为_____________ ;二氧化碳(CO2)分子中,两个C=O键的夹角接近180°,说明CO2分子的空间构型为____________ ;甲烷(CH4)分子中,四个H-C键的夹角接近109°28′,说明CH4分子的空间构型为______________ 。
参考答案:V形;直线形;正四面体
本题解析:
本题难度:一般
4、选择题 下图是从NaCl或CsCl晶体结构图中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( ? )
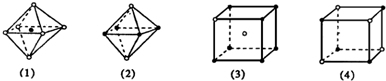
A.图(1)和图(3)
B.图(2)和图(3)
C.图(1)和图(4)
D.只有图(4)
参考答案:C
本题解析:
本题难度:简单
5、选择题 CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中不正确的是
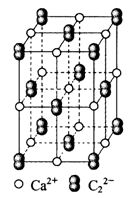
A.1个Ca2+周围距离最近且等距离的C22-数目为6
B.该晶体中的阴离子与F2是等电子体
C.6.4克CaC2晶体中含阴离子0.1mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
参考答案:B
本题解析:CaC2晶体的晶胞结构与NaCl晶体的相似,所以1个Ca2+周围距离最近且等距离的C22-数目为6个,选项A正确;原子数和电子数分别都相等的是等电子体,因此该化合物和F2不是等电子体,B不正确;该化合物的相对分子质量是64,则6.4克CaC2晶体的物质的量是0.1mol,含阴离子0.1mol,C正确;同样根据晶胞结构可知,选项D正确,答案选B。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和训练。该题的关键是掌握好氯化钠的晶胞结构特点,然后进行类推即可,有利于培养学生的逻辑推理能力和知识的迁移能力,也有助于培养学生的抽象思维能力。
本题难度:一般