| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《离子共存》试题特训(2017年最新版)(四)
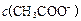 > >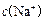 > >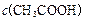 > >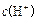 > >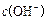 参考答案:D 本题解析:略 本题难度:一般 3、选择题 在无色透明溶液中,不能大量共存的离子组是( ) 参考答案:A.Cu2+为蓝色,与无色不符,故A选; 本题解析: 本题难度:一般 4、选择题 在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( ) |
参考答案:D
本题解析:A、在含等物质的量的AlO2-、OH-、CO32--的溶液中,逐滴加入盐酸,则氢离子先于氢氧根离子反应,再和偏铝酸根离子反应,最后与碳酸根离子反应,错误;B、I-、Br-、Fe2+的还原性的强弱是I-、Fe2+、Br-,所以氯气最后与溴离子反应,错误;C、二氧化碳先与氢氧根离子反应生成碳酸钙离子,因为溶液中存在钡离子,所以再与钡离子反应生成碳酸钡沉淀,所以相对于先与氢氧化钡反应,再与氢氧化钾、碳酸钾、碳酸钡反应,错误;D、Fe3+、Cu2+、H+的氧化性的强弱是Fe3+>Cu2+>H+,所以Zn先与Fe3+,再与Cu2+、H+反应最后与生成的亚铁离子反应,正确,答案选D。
考点:考查物质反应的先后顺序的判断
本题难度:困难
5、选择题 常温下,下列各组离子在指定溶液中一定能大量共存的是(?)
A.c(OH-)/c(H+)=1010的溶液:K+、Fe3+、Cl-、NO3-
B.能生成Al(OH)3的溶液中:Na+、K+、ClO-、SO32-
C.能使酚酞变红的溶液:Na+、Ba2+、NO3-、I-
D.澄清透明的无色溶液:NH4+、K+、MnO4-、SO42-
参考答案:C
本题解析:c(OH-)/c(H+)=1010的溶液是碱性溶液,Fe3+不能存在。能生成Al(OH)3的溶液中,或酸性或碱性,ClO-、SO32-在酸性溶液中不能存在。澄清透明的无色溶液,MnO4-有颜色不能存在。答案选C。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《实验方案的.. | |