微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关电解精炼铜的说法中错误的是
A.粗铜做阴极
B.电解一段时间后,溶液中会存在锌、铁等不活泼的金属阳离子
C.阳极泥中含有金、银等贵重金属
D.电解质溶液可以选用硫酸铜溶液
参考答案:A
本题解析:电解精炼铜时粗铜必须作阳极,精铜作阴极,硫酸铜作电解质溶液。A不正确,D正确。粗铜中含有比铜活泼的金属,电解时先失去电子,B正确。同时粗铜中也含有比铜不活泼的金、银等贵重金属,在电解时不会失去电子,故而形成阳极泥。答案是A。
本题难度:一般
2、简答题 在课堂上,老师提出“电解CuCl2溶液的过程中pH如何变化”的问题,让同学们展开探究式的讨论.一部分同学依据理论认为:电解CuCl2溶液一段时间后,溶液的pH会升高;另一部分同学持怀疑态度,课后做实验得出如下数据:
请回答下列问题:
(1)电解前溶液pH=4的原因是(用离子方程式说明)______.
(2)部分同学认为pH会升高的依据是______.
(3)另一部分同学实验后的结论是______.
(4)你同意哪种观点?______,理由______.
参考答案:(1)氯化铜属于强酸弱碱盐,铜离子水解而使其溶液呈酸性,水解方程式为:Cu2++2H2O?Cu(OH)2+2H+,故答案为:Cu2++2H2O?Cu(OH)2+2H+;
(2)铜离子存在水解平衡,电解时,阴极上铜离子放电生成铜,溶液中铜离子浓度逐渐减小,抑制铜离子水解,则氢离子浓度减小,所以PH增大,故答案为:溶液中存在铜离子水解平衡,电解时铜离子浓度减小,平衡向左移动,氢离子浓度减小,pH增大;
(3)根据电解过程中pH变化知,随着反应的进行,溶液的PH逐渐减小,故答案为:从实验中可知,电解氯化铜溶液pH减小;
(4)电解生成的氯气溶于水生成酸,Cl2+H2O=HCl+HClO,酸电离出氢离子而使溶液呈酸性,且随着反应的进行酸性逐渐增强,故答案为:pH减小的观点;电解过程中生成的氯气,氯气和水反应生成盐酸和次氯酸,溶液的酸性增强.
本题解析:
本题难度:简单
3、填空题 如图为相互串联的甲乙两电解池
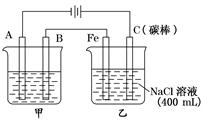
试回答:
(1)甲池若为用电解原理精炼铜的装置,则A是?极,材料是?,
电极反应为?。
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe极附近呈?色.
(3)若甲池为电解精炼铜,阴极增重12.8g,则:乙池中阳极放出的气体在标准状况下的体积为
?;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为?。
参考答案:1)阴极;纯铜;Cu2++2 e- =" Cu" ;(2)红;
(3)4.48L;1mol/L
本题解析:结合装置图,与电源负极相连的是阴极,与电源正极相连的是阳极,甲池若为用电解原理精炼铜的装置,则A是阴极,材料为纯铜,发生电极反应是Cu2++2 e- = Cu。
乙池中实质是电解NaCl饱和溶液,C极上放出Cl2,Fe极上生成H2 ,2H2O+2e-=H2↑+2OH,若滴入少量酚酞试液,电解一段时间后Fe极附近呈红色。若甲池为电解精炼铜,阴极增重12.8g,即转移的电子有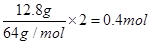 ,则乙池中阳极放出的气体在标准状况下的体积为
,则乙池中阳极放出的气体在标准状况下的体积为
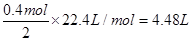 ;产生OH-有0.4mol,若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为
;产生OH-有0.4mol,若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为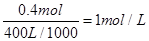 。
。
点评:考查电解池实验装置图,难度不大,解题的关键是要区分正负极,电极发生的反应,把握得失电子情况,仔细计算。
本题难度:一般
4、选择题 将0.1 L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
A.只有Cl2
B.只有O2
C.既有Cl2又有O2
D.只有H2