微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 尽管氮元素在地壳中的丰度较低(主要以硝酸盐的形式存在),在所有元素中仅排31位,但是大气中有丰富的氮气,这为氨和硝酸的广泛应用提供了可能。
(1)氮气的电子式为?,雷电作用能进行氮的固定,写出反应方程式?。
(2)食物蕴含的营养物质中,含氮的高分子化合物是??(填名称),其水解的最终产物为?。
(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣,写出其离子方程式: ?。
(4)某铜铝合金用足量稀硝酸完全溶解,得到标准状况下NO 11.2 L,再向溶液中加入过量氨水,充分反应后过滤。①滤液显深蓝色是因为含有的离子(填化学式).?。②若沉淀质量为7.8g,则合金的质量为?g。
参考答案:(1)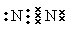 ? N2+O2
? N2+O2 2NO;?(2)蛋白质,氨基酸;
2NO;?(2)蛋白质,氨基酸;
(3)NH4++2O2 NO3-+H2O+2H+?(4)Cu(NH3)42+?;41.1
NO3-+H2O+2H+?(4)Cu(NH3)42+?;41.1
本题解析:(1)在N2分子中两个N原子共用三对电子。所以氮气的电子式为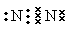 。在电火花作用下N2与O2发生反应得到NO。反应的方程式为N2+O2
。在电火花作用下N2与O2发生反应得到NO。反应的方程式为N2+O2 2NO。(2)食物蕴含的营养物质中,含氮的高分子化合物是蛋白质,蛋白质是有许多的氨基酸分子通过脱水缩合而成。因此其水解的最终产物为氨基酸。(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣。反应的离子方程式NH4++2O2
2NO。(2)食物蕴含的营养物质中,含氮的高分子化合物是蛋白质,蛋白质是有许多的氨基酸分子通过脱水缩合而成。因此其水解的最终产物为氨基酸。(3)土壤中的NH4+在硝化细菌的催化作用下可转化为NO3﹣。反应的离子方程式NH4++2O2 NO3-+H2O+2H+。(4)某铜铝合金用足量稀硝酸完全溶解,发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O.再向溶液中加入过量氨水时,由于氨水为弱碱,不能溶解产生的Al(OH)3沉淀。所以发生反应:Al(NO3)3+3NH3·H2O= Al(OH)3↓+ 3NH4NO3;Cu(NO3)2+6NH3·H2O=[Cu(NH3)4](OH)2+2H2O+ 2NH4NO3.①滤液显深蓝色是因为含有的离子铜氨络离子——四氨合铜离子[Cu(NH3)4] 2-。n(Al(OH)3)=7.8g÷78g/mol="0.1mol." m(Al)=2.7g.根据方程式 Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O可知Al产生的NO的物质的量为0.1mol,则Cu产生的NO的物质的量为0.5mol-0.1mol=0.4mol.由方程式 3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O可知Cu的物质的量为0.6mol.m(Cu)=" 0.6mol" ×64g/mol=38.4g.所以合金的质量为38.4g=41.1g。
NO3-+H2O+2H+。(4)某铜铝合金用足量稀硝酸完全溶解,发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O。Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O.再向溶液中加入过量氨水时,由于氨水为弱碱,不能溶解产生的Al(OH)3沉淀。所以发生反应:Al(NO3)3+3NH3·H2O= Al(OH)3↓+ 3NH4NO3;Cu(NO3)2+6NH3·H2O=[Cu(NH3)4](OH)2+2H2O+ 2NH4NO3.①滤液显深蓝色是因为含有的离子铜氨络离子——四氨合铜离子[Cu(NH3)4] 2-。n(Al(OH)3)=7.8g÷78g/mol="0.1mol." m(Al)=2.7g.根据方程式 Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O可知Al产生的NO的物质的量为0.1mol,则Cu产生的NO的物质的量为0.5mol-0.1mol=0.4mol.由方程式 3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O可知Cu的物质的量为0.6mol.m(Cu)=" 0.6mol" ×64g/mol=38.4g.所以合金的质量为38.4g=41.1g。
本题难度:一般
2、选择题 元素符号、反应方程式、结构示意图、电子式、结构式、球棍模型、比例模型等通常叫做化学用语。下列有关化学用语的表示方法中错误的是(?)
A.Na2O2的电子式:
B.K+的结构示意图: 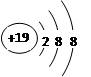
C.甲烷的比例模型: 
D.丙烷分子的结构简式:CH3—CH2—CH3
参考答案:C
本题解析:选项ABD都是正确的,C不正确,该模型表示的是球棍模型。比例模型应该是 ,因此答案选C。
,因此答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般
3、填空题 (12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2
参考答案:
本题解析:
本题难度:困难
4、选择题 已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
溶质的质量分数
| 甲溶液密度╱g·cm-3
| 乙溶液密度╱g·cm-3
|
1%
| 0.95
| 1.02
|
5%
| 0.92
| 1.04
|
9%
| 0.90
| 1.07
|
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
C.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
参考答案:B
本题解析:
本题考查溶质质量分数与溶液密度的关系,不管溶液的密度大小,若将两种不同浓度的溶液等质量混合,其质量分数等于两者的平均值,如果是等体积混合,当密度大于1时,其质量分数大于两者的平均值,而当密度小于1时,其质量分数小于两者的平均值,故本题只有C选项符合题意。
本题难度:一般
5、选择题 一定质量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,则完全燃烧1摩尔无水乙醇时放出的热量是( )
A.0.5Q
B.Q
C.2Q
D.5Q
参考答案:因生成的CO2用过量饱和石灰水完全吸收,可得100克CaCO3沉淀,
CaCO3的物质的量为100g100g/mol=1mol,
由碳元素守恒可知,二氧化碳的物质的量也为1mol,
即生成1mol二氧化碳放出的热量为Q,
而完全燃烧1摩尔无水乙醇时生成2mol二氧化碳,
则放出的热量为Q×2=2Q,
故选C.
本题解析:
本题难度:一般