微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列能用勒夏特列原理解释的是
①棕红色NO2加压后颜色先变深后变浅?②FeCl3溶液加热后颜色加深
③Fe(SCN)3溶液中加入固体KSCN后颜色变深?④氯水宜保存在低温、避光条件下?⑤向H2S水溶液中加入NaOH有利于S2-增多?⑥合成氨时将氨液化分离,可提高原料的利用率?⑦向AgCl悬浊液中加入KI溶液有黄色沉淀生成
A.①②⑤⑥
B.②③④⑦.
C.①③⑤⑦
D.全部
参考答案:D
本题解析:
正确答案:D
①2NO2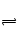 N2O4加压后向气体体积缩小的方向移动。②Fe3++3H2O
N2O4加压后向气体体积缩小的方向移动。②Fe3++3H2O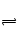 Fe(OH)3+3H+ 水解吸热,加热促进水解③增加SCN―浓度,平衡向生成络合物的方向移动④光照HClO易分解,平衡向溶解的方向移动⑤碱中和H+ ,促进H2S电离⑥降低生成物浓度,促进平衡正确向移动⑦增加I―浓度,沉淀转化成AgI.
Fe(OH)3+3H+ 水解吸热,加热促进水解③增加SCN―浓度,平衡向生成络合物的方向移动④光照HClO易分解,平衡向溶解的方向移动⑤碱中和H+ ,促进H2S电离⑥降低生成物浓度,促进平衡正确向移动⑦增加I―浓度,沉淀转化成AgI.
本题难度:一般
2、选择题 在一定温度和压强下,下列各可逆反应达到化学平衡

状态,各反应有如图所示的对应关系:
(1)N2(g)+3H2(g) 2NH3(g)?△H<0(曲线Ⅰ)?
2NH3(g)?△H<0(曲线Ⅰ)?
(2)H2(g)+I2(g) 2HI(g)?△H>0(曲线Ⅱ)
2HI(g)?△H>0(曲线Ⅱ)
(3)2SO3(g) 2SO2(g)+O2(g)?△H>0(曲线Ⅲ)
2SO2(g)+O2(g)?△H>0(曲线Ⅲ)
则图像中y轴可以表示?(?)?
①平衡混合气中一种生成物的体积分数?②平衡混合气中一种反应物的体积分数?③平衡混合气中一种生成物的产率?④平衡混合气中一种反应物的转化率
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:C
本题解析:对于反应(1),加压平衡正向移动,生成物的体积分数增加,生成物的产率增加,反应物的体积分数减小,反应物的转化率增加。
对于反应(2),加压平衡不移动,生成物的体积分数、生成物的产率、反应物的体积分数、反应物的转化率均不变。
对于反应(3),加压平衡逆向移动,生成物的体积分数减小,生成物的产率减小,反应物的体积分数增加,反应物的转化率减小 。
综上所述,答案为C。
本题难度:一般
3、选择题 在一定温度下,将等物质的量的CO和水蒸气通人恒容密闭容器中,发生如下反应:
CO(g)+H2O(g)  ?CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是
?CO2(g)+H2(g),一段时间后反应达到平衡。对该平衡状态描述正确的是
A.正反应速率等于零
B.正反应速率大于逆反应速率
C.正反应速率等于逆反应速率
D.正反应速率小于逆反应速率
参考答案:C
本题解析:平衡状态是一个动态平衡,是指正反应速率和逆反应速率相等。
本题难度:简单
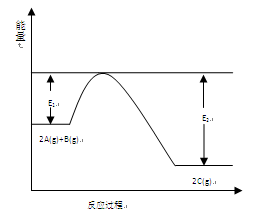
4、填空题 (9分)一定条件下,在一容积可变的密闭容器中,反应: 过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
过程中的能量变化如图所示。反应过程中,A、B、C的物质的量(mol)的变化如下表:
时间(min)
| 0
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
|
n(A)
| 2.00
| 1.90
| 1.82
| 1.76
| 1.64
| 1.54
| 1.50
| 1.50
| 1.50
|
n(B)
| 1.00
| 0.95
| 0.91
| 0.88
| 0.82
| 0.77
| 0.75
| 0.75
| 0.75
|
n(C)
| 0
| 0.10
| 0.18
| 0.24
| 0.36
| 0.46
| 0.50
| 0.50
| 0.50
|
回答下列问题:
(1)反应 的正反应△H?(填“大于”或“小于”)0。
的正反应△H?(填“大于”或“小于”)0。
(2)该反应平衡时,下列说法不正确的是?
(A)气体的密度不再改变?(B)A的物质的量浓度不变
(C)放出或吸收的热量不再变化?(D)v正(A)=v逆(A)=0
(3)toC时,在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,在一定条件下发生反应,反应中C的物质的量浓度变化情况如下图:
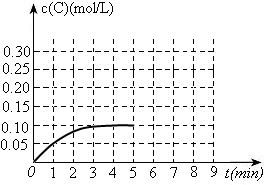
①该温度下,反应: 的平衡常数K=?。
的平衡常数K=?。
②反应进行到1分钟时B物质的量为?。
③在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在上图中画出第5min到新平衡时C的物质的量浓度的变化曲线。
参考答案:(共9分)
(1)<?(2)D (3)①? 4?②0.55mol?③画图
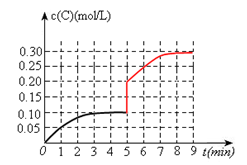
本题解析:(1)产物总能量小于反应物总能量,故正反应是放热反应,△H<0
(2)化学平衡是一动态平衡,v正(A)=v逆(A)≠0
(3)①由图可知,平衡时c(C)=0.1mol/L,由方程式可求出c(A)、c(B)分别为0.1mol/L、0.25mol/L,进而可求出K=4
②由图可知,反应进行到1分钟时c(C)=0.05mol/L,即0.1mol,可求出B消耗了0.05mol;还剩余0.55mol
③在第5min时,将容器的体积缩小一半,c(C)瞬间增大一倍,即0.2mol/L;在第8min达到新的平衡时A的总转化率为75%,则可求出生成C为0.3mol,c(C)=0.3mol/L。
本题难度:一般
5、填空题 (10分) 在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:2X(g)+Y(g)? ?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
?aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;
平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是__________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为__________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?__________,其理由是____________________。
(4)维持温度、体积不变,若起始时向容器中加入的物质的量如下列各项,反应达到平衡后放出的热量仍为Q1 kJ的是__________(稀有气体不参与反应)。
A.2 mol X、1 mol Y、1 mol Ar
B.a mol Z、1 mol W
C.1 mol X、0.5 mol Y、0.5a mol Z、0.5 mol W
D.2 mol X、1 mol Y、1 mol Z
参考答案:(1)减少?(2)a=1? (3)正确?反应物没有完全转化,所以放出的热量少?
(4)ABC?(每空2分)
本题解析:(1)ΔH<0,说明是个放热反应,故升高温度,反应向左进行,故平衡常数减小,平衡常数为生成物的化学计量数次幂比上反应物的化学计量数次幂。
(2)升高温度,反应向左进行,混合气体的平均相对分子质量减小,说明生成物的化学计量数之和小于反应物的化学计量数之和,故a+1<3,a<2,故a为1。
(3)反应物没有完全转化,所以放出的热量少,故Q1一定小于Q。
(4)利用“一边倒”的方法计算X和Y的物质的量和开始加入的2 mol X和1 mol Y相比,若一样,则相等,此外,还要考虑,对于体积固定的密闭容器,加入惰性气体是没有影响反应方向。
点评:此题考核了对化学平衡常数的理解和掌握。
本题难度:困难