微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列有关纯铁的描述正确的是(? )
A.熔点比生铁的低
B.与相同浓度的盐酸反应生成氢气的速率比生铁的快
C.在潮湿空气中比生铁容易被腐蚀
D.在冷的浓硫酸中可钝化
参考答案:D
本题解析:生铁是铁与碳的合金,由于合金的熔点通常低于任一组成部分的熔点,故A错;生铁与酸反应及在潮湿的空气中均比纯铁快得多,故B、C错,铁在常温下在浓硫酸、浓硝酸中发生钝化,D正确。
本题难度:简单
2、选择题 在由Fe、FeO和Fe2O3组成的混合物中加入100 mL 2 mol·L-1的盐酸,恰好使混合物完全溶解,并放出448 mL气体(标准状况),此时溶液中无Fe 3+存在。则下列判断正确的是
(?)
A.混合物中三种物质反应所消耗的盐酸的物质的量之比为1∶1∶3
B.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.反应后所得溶液中的Fe2+与Cl-的物质的量之比为1∶3
参考答案:C
本题解析:由题意,由于反应中有气体放出且溶液中不存在Fe3+,则n(Fe)>n(Fe2O3),与FeO的物质的量无关。最终产物为FeCl2,则n(Fe2+)=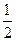 n(Cl-)。
n(Cl-)。
本题难度:简单
3、填空题 (14分)回答下列关于铁元素及其化合物的知识:
(1)向一支装有FeCl3溶液的试管中滴加NaOH溶液,现象为 _________________,
其中含铁元素的产物的化学式是___________________ ;
(2)为了检验某未知溶液是否含有Fe2+离子,两位同学分别设计了以下实验方案加以证明。方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现红色,证明该未知溶液含有Fe2+离子;
方案二:向另一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,溶液变为红色,证明该未知溶液含有Fe2+离子;
则请回答:①你认为哪个方案较为合理 __________________ ;
②写出Fe2+与氯气反应的离子方程式 ____________________________;
③实验室在保存含有Fe2+离子的溶液时,为了防止Fe2+离子变质,经常向其中加入铁粉,
其原因是(用离子方程式表示)__________________________________________
(4)鲜榨苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,鲜榨的苹果汁在空气中会由淡绿色的Fe2+变为棕黄色的Fe3+,则这个变色的过程中Fe2+被______ ;若在榨汁的时候加入适量的维生素C,可有效防止这种现象的发生。这说明维生素C具有_______。
A.氧化性
B.还原性
C.酸性
D.碱性
参考答案:(1)红褐色沉淀? Fe(OH)3;
(2)①方案二
②2Fe2++ Cl2? =? 2Fe3+ + 2Cl-
③2Fe3+ + Fe? = 3Fe2+
(4)被氧化 ?B
本题解析:遇KSCN溶液呈血红色是Fe3+的特征反应,根据Fe3+的特征反应先加KSCN溶液,确定是否含有Fe3+;如果没有Fe3+,根据氯水的性质,再向溶液中加入氯水,观察溶液的颜色是否变化,从而确定是否含有Fe2+。
Fe2+与KSCN溶液反应无血红色出现,但Fe3+与KSCN反应产生血红色,因此,要证明某溶液中有无Fe2+,则先要在溶液中加入KSCN溶液,没有出现血红色,再向其中加入氯水出现血红色,则证明原溶液中含Fe2+。
点评:本题考查了Fe2+的检验方法,Fe2+呈中间价态,既有氧化性又有还原性,能被氯水等强氧化剂氧化成Fe3+,利用Fe3+的特征反应检验Fe2+的存在是较好的方法,但首先要排除Fe3+的干扰。
本题难度:一般
4、填空题 (6分)已知A为生活中最常见金属,有以下物质相互转化

试回答:(1)写出B的化学式?,D的化学式?。
(2)写出由E转变成F的化学方程式?。
(3)向G溶液加入A的有关离子反应方程式??。
参考答案:(1)B:FeCl2,D:KCl。(2)? 4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)Fe+2Fe3+=3Fe2+。
本题解析:A为生活中最常见金属即为本题的突破口,是铁,铁一般与酸反应产生氢气和亚铁离子;又因为D溶液与硝酸银反应生成白色沉淀,说明含有氯离子,白色沉淀在空气中迅速转化为红褐色沉淀,说明E为氢氧化亚铁,F为氢氧化铁,G为氯化铁,B为氯化亚铁,D为氯化钾,H为氯化银。(1)B的化学式为FeCl2,D的化学式为KCl。(2)E到F即氢氧化亚铁与氧气和水反应生成氢氧化铁: 4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)氯化铁与铁生成的是氯化亚铁:Fe+2Fe3+=3Fe2+。
点评:抓住突破口是解决本题的关键。难度不大。
本题难度:一般
5、实验题 (12分)图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑和6mol·L-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是 ? 。A中反应的离子方程式是 ?。
(2)实验开始时先应将活塞D (填“打开”“关闭”或“无关系”),C中收集到气体的主要成分是 。
(3)简述生成Fe(OH)2的操作过程 。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式 。
参考答案:(1)铁屑,Fe+2H+=Fe2++H2↑?(2)打开,H2
(3)关闭活塞D,使FeSO4溶液压入B瓶中进行反应
(4)4Fe(OH)2+O2+2H2O=4Fe(OH)3
本题解析:(1)A装置是制取FeSO4的装置,所以先加入的试剂是铁屑,发生的离子反应为Fe+2H+=Fe2++H2↑。
(2)实验开始时,应该先排除装置中的空气,所以应该先把活塞D打开,让产生的氢气充满整个装置。
(3)当整个装置充满氢气后,关闭活塞D,由于A中继续产生气体会将生成的FeSO4压入到B装置中,因此反应产生了Fe(OH)2。
(4)空气进入会将Fe(OH)2氧化,其反应为:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
点评:本题的关键是要分析出活塞D的用处。
本题难度:一般