|
高中化学必备知识点《工业制硫酸》在线测试(2017年最新版)(十)
2017-08-08 05:00:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(如图).按此密闭体系中气体的流向,则在A处流出的气体为( )
A.SO2
B.SO3,O2
C.SO2,SO3
D.SO2,O2
| 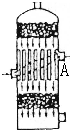
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列材料中最不适宜制造储存浓硫酸的容器的是
A.铁
B.铝
C.铜
D.陶瓷
参考答案:C
本题解析:铁、铝在冷的浓硫酸中发生钝化,陶瓷与浓硫酸不反应。铜能与浓硫酸反应,不能用铜为原料制造储存浓硫酸的容器。
本题难度:一般
3、简答题 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
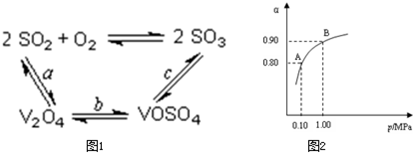
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入______(填设备名称),其主要目的是______.
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1).其中a、c二步的化学方程式可表示为:______、______.
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图2所示.则:将2.0mol?SO2和1.0mol?O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M?Pa.该反应的平衡常数等于______.A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是______.
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,
回收率达91.7%以上.已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣.查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水.该工艺的流程如图.
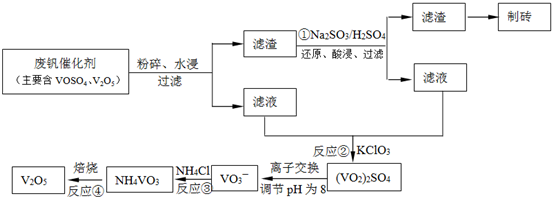
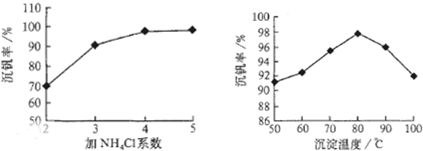
则:反应①②③④中属于氧化还原反应的是______(填数字序号),反应①的离子方程式为______.该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图试建议控制氯化铵系数和度:______、______.
参考答案:(1)以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收;其中二氧化硫的催化氧化在催化剂表面和空气中的氧气接触反应,若气体中含有杂质气体容易使催化剂中毒,所以煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥;故答案为:接触室,防止催化剂中毒.
(2)依据图1中的转化关系,V2O5参与反应先做氧化剂把二氧化硫氧化为三氧化硫,本身被还原为图中产物V2O4;根据氧化还原反应的实质写出并配平a步化学方程式SO2+V2O5?SO3+V2O4;C是VOSO4转化为SO3,此过程需要重新生成催化剂V2O5,需要氧化剂完成,此过程中的氧化剂时氧气,根据化合价的变化写出C步化学方程式?4VOSO4+O2?2V2O5+4SO3;故答案为:4VOSO4+O2?2V2O5+4SO3
(3)2SO2+O2催化剂.△2SO3 体系总压强为0.10M?Pa,此时二氧化硫的转化率为80%
? 2SO2 +O2催化剂.△2SO3
起始量(mol)? 2?1? ?0
变化量(mol)? ? 2×0.8? 0.8? 2×0.8
平衡量(mol)? ? 0.4? 0.2? 1.6
平衡时各物质的浓度为:[SO2]=0.08mol/L,[O2]=0.04mol/L,[SO3]=0.32mol/L,代入平衡常数的计算式得到平衡常数K=[SO2]2??[SO2]2?[O2]=400?L?mol-1,
从图象中可以看出,常压SO2就可以达到较高的转化率,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;
故答案为:400?L?mol-1,使用常压SO2就可以达到较高的转化率;
(4)依据离子交换法回收钒的新工艺流程图分析反应过程中:
①的目的是把难溶的五氧化二钒还原为溶于水的VOSO4;
②的目的是用KClO3还原为VOSO4为(VO2)2SO4;
③因为NH4VO3难溶于水,此步骤的目的是沉淀VO3-
④是分解NH4VO3得到V2O5;
工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图示分析数据,80℃时沉矾率最高为98%,所以加NH4Cl的系数从图中读出为4;
故答案为:①②;V2O5+SO32-+4H+=2VO2++SO42-+2H2O;4和80℃;
本题解析:
本题难度:一般
4、选择题 接触法制硫酸的过程中,对废气、水、渣、热的处理正确的是
①尾气用氨水处理
②污水用石灰乳处理
③废渣用来制水泥、炼铁
④设置热锅炉产生蒸气、供热或发电
A.①②③④都正确
B.只有①②③正确
C.只有②③④正确
D.只有①②④正确
参考答案:A
本题解析:
本题难度:困难
5、选择题 下列实验方案中,合理的是
A.可用生石灰除去乙酸中少量水
B.用5?mL苯与1mL浓溴水反应(Fe粉作催化剂)制溴苯
C.向适量浓硝酸、浓硫酸的混合物中逐滴加入苯,在50-60℃的水浴中加热以制取硝基苯
D.将2.5g?苯酚、2.5mL40%的甲醛溶液混合,沸水浴加热制酚醛树脂
参考答案:C
本题解析:分析:A.生石灰与乙酸反应;
B.苯与液溴制备溴苯;
C.苯的密度比水小,制备硝基苯需要水浴加热;
D.苯酚过量,应在酸性条件下.
解答:A.生石灰与乙酸反应,则不能用生石灰除去乙酸中少量水,故A错误;
B.苯与液溴制备溴苯,而不能利用浓溴水,故B错误;
C.苯的密度比水小,则向适量浓硝酸、浓硫酸的混合物中逐滴加入苯,然后在50-60℃的水浴中加热制备硝基苯,故C正确;
D.苯酚过量,应在酸性条件下,则将2.5g?苯酚、2.5mL40%的甲醛溶液混合,再加入2mL浓盐酸,然后沸水浴加热制酚醛树脂,故D错误;
故选C.
点评:本题考查化学实验方案的评价,涉及除杂、物质的制备,注意常见水浴加热的实验,实验细节是考查的重点,选项D为解答的难点,题目难度较大.
本题难度:困难
| 