微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室可用下列方法制取氯气:
MnO2+4HCl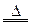 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
KClO3+6HCl KCl+3Cl2↑+3H2O
KCl+3Cl2↑+3H2O
NaClO+2HCl NaCl+Cl2↑+H2O
NaCl+Cl2↑+H2O
Ca(ClO)2+4HCl CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
若制取Cl2的质量相同,则转移电子的物质的量之比为()
A.1∶ ∶1∶
∶1∶ ∶1
∶1
B.2∶ ∶3∶1∶
∶3∶1∶
C.1∶1∶1∶1∶1
D.2∶2∶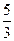 ∶1∶1
∶1∶1
参考答案:D
本题解析:本题可从反应转移电子数入手分析:
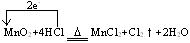
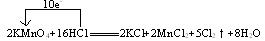

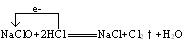

氯气的制取原理是用氧化剂氧化Cl-而得到氯气,若使用KClO3,则转移5 mol e-,可得Cl2 3 mol。制取1 mol Cl2转移电子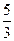 ?mol。若用Ca(ClO)2,每生成1 mol Cl2转移1 mol e-,也就是1 mol Cl-被氧化,1 mol
?mol。若用Ca(ClO)2,每生成1 mol Cl2转移1 mol e-,也就是1 mol Cl-被氧化,1 mol 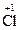 被还原,两者结合为1 mol Cl2。因为在反应生成的Cl2中,包括被氧化的氯和由高价被还原为0价的氯,所以生成氯气的物质的量和转移电子的物质的量之比与前一种情况不同,且随反应物的不同,其比值也不同。
被还原,两者结合为1 mol Cl2。因为在反应生成的Cl2中,包括被氧化的氯和由高价被还原为0价的氯,所以生成氯气的物质的量和转移电子的物质的量之比与前一种情况不同,且随反应物的不同,其比值也不同。
根据电子转移数和化学方程式计算,上述五种氧化剂在制取1 mol Cl2时,转移电子的物质的量之比为2∶2∶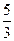 ∶1∶1。
∶1∶1。
本题难度:简单
2、简答题 实验室欲配制0.5mol/L的NaOH溶液500mL:
(1)需称取NaOH固体的质量为______g
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图1所示.由图可见,该同学在操作时的一个明显错误是______,烧杯的实际质量为______.
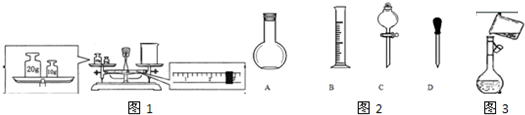
(3)在图2所示仪器中,配制上述溶液肯定不需要的是______(填序号).
(4)在容量瓶的使用方法中,下列操作正确的是______(可多选)
A.使用容量瓶前 应首先检验是否漏水.
B.容量瓶用水洗净后,再用待配溶液润洗2~3次.
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线.
D.如果配制溶液时,溶质溶解速率比较慢,可以将容量瓶在酒精灯上加热,促进溶质的溶解,节省配制溶液的时间.
E.洗烧杯和玻璃棒的洗涤液必须转移入容量瓶中,不能倒掉.
(5)图3是该同学转移溶液的示意图,该同学在操作过程中存在明显的错误为:______.
(6)在配制该溶液过程中,下列操作会引起配制溶液浓度偏高的是______.
①没有洗涤烧杯和玻璃棒?②所用天平的砝码生锈
③容量瓶不干燥,含有少量蒸馏水?④定容时俯视标线
⑤定容时仰视标线
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线.
参考答案:(1)需氢氧化钠的质量为:0.5L×0.5mol?L-1×40g/mol=10.0g;
故答案为:10.0;
(2)天平称量遵循左物右码,由图可见烧杯与砝码的位置放反了;
由图可知,游码的读数为2.6g,砝码的质量为10g,根据左盘内质量=右盘内质量+游码读数,烧杯的实际质量为30g-2.6g=27.4g;
故答案为:烧杯与砝码的位置放反了;27.4g;
(3)操作步骤有计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等操作,用托盘天平称量氢氧化钠,用药匙取药品,在烧杯中溶解(可用量筒加水),用玻璃棒搅拌,加速溶解,恢复到室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所用仪器有:托盘天平、500mL容量瓶、烧杯、玻璃棒、胶头滴管、药匙、量筒(可用可不用),
肯定不需要的是:C(分液漏斗);
故答案为:C;
(4)A.配制需反复颠倒摇匀,使用容量瓶前应首先检验是否漏水,故A正确;
B.容量瓶用水洗净后,再用待配溶液润洗2~3次,容量瓶内壁沾有少量溶质,所配溶液浓度偏高,故B错误;
C.在容量瓶内直接溶解固体,会有热效应,影响溶液体积,溶解放出的热量,可能使容量瓶受热不均,导致容量瓶破裂危险,故C错误;
D.将容量瓶在酒精灯上加热,使容量瓶受热不均,导致容量瓶破裂危险,故D错误;
E.洗烧杯和玻璃棒的洗涤液中含有少量溶质,必须转移入容量瓶中,故E正确;
故选AE;
(5)由图可知,操作过程中存在明显的错误为:转移溶液未用玻璃棒引流;
故答案为:转移溶液未用玻璃棒引流;
(6)①未洗涤烧杯、玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,所配溶液浓度偏低;
②所用天平的砝码生锈,砝码的质量增大,称量氢氧化钠的质量偏大,所配溶液的浓度偏高;
③最后需要定容,容量瓶不干燥,含有少量蒸馏水,对溶液浓度无影响;
④定容时,俯视容量瓶刻度线,使溶液的体积偏低,所配溶液浓度偏高;
定容时,仰视容量瓶刻度线,使溶液的体积偏大,所配溶液浓度偏低;
⑥摇匀后液面下降,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所配溶液浓度偏低;
偏高的是?②④;
故选②④.
本题解析:
本题难度:一般
3、选择题 在标况下,2.24L NOx气体的质量为3g则x值为( )
A.1
B.2
C.3
D.4