微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是( )
A.铅蓄电池放电时铅电极发生还原反应
B.电解饱和食盐水在阳极得到氯气,阴极得到金属钠
C.给铁钉镀铜可采用CuSO4作电镀液
D.生铁浸泡在食盐水中发生析氢腐蚀
参考答案:A.铅蓄电池放电时铅电极为原电池的负极,发生氧化反应,正极发生还原反应,故A错误;
B.电解饱和食盐水得到氢气、氯气和氢氧化钠,阴极上得到氢气和氢氧化钠,故B错误;
C.电镀时用含镀层金属的阳离子的盐做电解质溶液,则给铁钉镀铜可采用CuSO4作电镀液,故C正确;
D.生铁浸泡在食盐水中发生吸氧腐蚀,在酸性溶液中发生析氢腐蚀,故D错误.
故选C.
本题解析:
本题难度:一般
2、选择题 下列装置能够组成原电池的是
[? ]
A.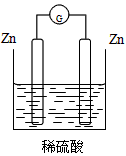
B.
C.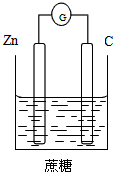
D.
参考答案:B
本题解析:
本题难度:简单
3、选择题 有a、b、c、d四种金属,将a与b用导线连结起来浸入电解质溶液中,b不易腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈。将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出,据此判断它们的活动性由强到弱的顺序是
[? ]
A.d、c、a、b
B.b、a、d、c
C.d、b、a、c
D.d、a、b、c
参考答案:D
本题解析:
本题难度:一般
4、实验题 (16分)MnO2是重要无机材料,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3,其中Fe2O3质量百分含量为10%)样品转化为纯MnO2实验,其流程如下:
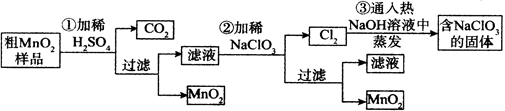
(已知:氧化性强弱顺序: ClO3-> MnO2 > Fe3+)
(1)铝与二氧化锰在高温下发生铝热反应,相关反应的化学方程式为: 。
(2)第②步反应离子方程式为: 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、 、 ;
第③步蒸发得到的固体中除了含有NaClO3和NaOH外,还一定含有 (写化学式)。
(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是: 。
(5)若粗MnO2样品的质量为28.2g,第①步反应后,经过滤得到17.4g MnO2,并收集到448mL CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3才能将Mn2+完全转化为MnO2。
参考答案:(1)2Al+ 3MnO2 3Mn + 2Al2O3(3分)
3Mn + 2Al2O3(3分)
(2)5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+(3分)
(3)酒精灯 蒸发皿(2分,各1分)NaCl(2分)
(4)MnO2 + e- + H2O =" MnO(OH)" + OH-或2MnO2 + 2e- + H2O = Mn2O3 + OH-(3分)
(5)0.04(3分)
本题解析:(1)铝与二氧化锰在高温下发生铝热反应,产生氧化铝和锰,反应的化学方程式为:2Al+ 3MnO2 3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、MnCO3和Fe2O3,当加入稀硫酸时,MnO、MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O =" MnO(OH)" + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)=" n(MnO)+" n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)="2/5" n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
3Mn + 2Al2O3;(2)粗二氧化锰中含有MnO、MnCO3和Fe2O3,当加入稀硫酸时,MnO、MnCO3和Fe2O3会发生反应转化为可溶性的MnSO4、Fe2(SO4)3,将MnO2过滤除去,然后向溶液中加入稀NaClO3溶液, Mn2+被氧化为MnO2,根据电子守恒、原子守恒及电荷守恒可得第②步反应反应离子方程式为:5Mn2+ + 2ClO3- +4H2O =" 5" MnO2↓ + Cl2↑ + 8H+;(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、酒精灯 蒸发皿;第③步发生的是氧化还原反应,Cl2失去电子被氧化为NaClO3,则被还原得到的是NaCl,因此蒸发得到的固体中除了含有NaClO3和过量的未反应的NaOH外,还一定含有NaCl;(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极上发生还原反应,该电极的电极反应式是MnO2 + e- + H2O =" MnO(OH)" + OH-;(5)n(CO2)=0.448L÷22.4L/mol=0.02mol;则根据C元素守恒可得n(MnCO3)= n(CO2)= 0.02mol;若剩余的物质完全是MnO,则其物质的量是n(MnO)=(28.2g—17.4g—0.02mol×115g/mol—28.2g×10%)÷71g/mol=0.08mol, 溶液中含有的Mn2+的物质的量是n(Mn2+)=" n(MnO)+" n(MnCO3)= 0.08mol+0.02mol=0.1mol则根据方程式5Mn2+ + 2ClO3- +4H2O = 5MnO2↓ + Cl2↑ + 8H+可知消耗NaClO3的物质的量是n(NaClO3)="2/5" n(MnO)= 2/5×0.1mol=0.04mol, 即在第②步反应中至少需要0.04mol mol NaClO3才能将Mn2+完全转化为MnO2。
考点:考查化学反应方程式和离子方程式的书写、混合物分离方法的操作方法及仪器的使用、原电池电极反应式的书写、关于化学反应方程式的计算的知识。
本题难度:一般
5、填空题 (7分)硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ. SO2+2H2O+I2===H2SO4+2HI
Ⅱ. 2HI H2+I2
H2+I2
Ⅲ. 2H2SO4===2SO2+O2+2H2O
(1) 分析上述反应,下列判断正确的是_______________
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
(2) 一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
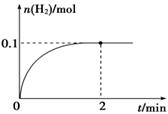
① 0~2 min内的平均反应速率v(HI)=________________
② 该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K=__________________
2HI(g)的平衡常数K=__________________
③ 相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_____________是原来的2倍。
a.平衡常数? b.HI的平衡浓度
c.达到平衡的时间? d.平衡时H2的体积分数
(3) 实验室用Zn和稀硫酸制取H2,反应时若加入少量下列试剂中的____________产生H2的速率将增大。
a.NaNO3?b.CuSO4?c.Na2SO4?d.NaHSO3
参考答案:(1)C(1分)(2)①0.1mol/(L.min)(2分) ②64 (2分) ③b (1分)(3)b(1分)
本题解析:(1)H2SO4在常温下,很稳定不易分解,这是常识,所以a是错误的;反应Ⅰ中SO2是还原剂,HI是还原产物,因此还原性SO2>HI,所以b不正确;将Ⅰ和Ⅱ分别乘以2和Ⅲ相加得:2H2O==2H2+O2,所以c正确,d是错误的,答案选c。
(2)①因为 υ (H2)="0." 1mol/1L/2min="0.05" mol·L-1·min-1,所以根据反应速率之比是相应的化学计量数之比可知,υ (HI)="2" υ (H2)="0.1" mol·L-1·min-1。
②? 2HI(g)==H2(g)+I2(g)
2? 1? 1
起始浓度/mol·L-1? 1? 0? 0
变化浓度/mol·L-1: 0.2? 0.1? 0.1
平衡浓度/mol·L-1: 0.8? 0.1? 0.1
所以该可逆反应的平衡常数K= =64mol/L。
=64mol/L。
③如果开始时加入HI的量是用来的2倍,则建立的平衡状态和原平衡状态相比是等比破坏,因此HI、H2、I2的物质的量、平衡浓度都是原来的两倍;但铬组分的百分含量、体积分数、平衡常数都是不变的。由于开始时的浓度增大了,反应速率加快,达平衡的时间不可能是原来的两倍,所以答案选b。
(3)水是弱电解质,存在电离平衡H2O=H++OH-,硫酸电离出的氢离子对水的电离是抑制作用,当锌消耗了氢离子后,氢离子浓度降低,促进水的电离;如果加入硝酸钠,则溶液洗相当于是硝酸溶液,此时不再生成氢气;加入的亚硫酸氢钠会和氢离子反应,降低氢离子浓度,反应速率降低;硫酸钠的加入对反应速率是无影响的;加入硫酸铜后,锌与置换出的Cu构成原电池,加快了反应速率,所以答案选b。
点评:该题是2010年山东卷28题,在能力方面考查了“能够将实际问题分解,通过运用相关知识,采用分析、综合的方法解决简单化学问题的能力”、“能够将分析解决问题的过程和成果用正确的化学术语及文字、图表、模型、图形等表达,并作出解释的能力”。试题设置了考生比较陌生的情景——“硫——碘循环分解水制氢”,对考生的心理素质要求较高。
本题难度:一般