微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 U、V、W、X、Y、Z是原子序数依次增大的六种常见元素.Y的单质在W2中燃烧的产物可使品红溶液褪色.Z和W元素形成的化合物Z3W4具有磁性.U的单质在W2中燃烧可生成UW和UW2两种气体.X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体.
请回答下列问题:
(1)V的单质分子的结构式为?;XW的电子式为?;Z元素在周期表中的位置是?.
(2)U元素形成的同素异形体的晶体类型可能是(填序号)?.
①原子晶体?②离子晶体?③分子晶体?④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)?;V、W的氢化物分子结合H+能力较强的是(写化学式)?,用一个离子方程式加以证明:?.
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为?.
参考答案:Y的单质在W2中燃烧的产物可使品红溶液褪色.该气体为SO2,则Y为S元素,W为O元素,Z和W元素形成的化合物Z3W4具有磁性,则Z3W4为Fe3O4,Z为Fe元素,U的单质在W2中燃烧可生成UW和UW2两种气体,应为CO和CO2气体,U为C元素,X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体,应为Mg和CO2的反应,则X为Mg元素,根据U、V、W、X、Y、Z是原子序数依次增大可知V为N元素,
(1)V为N元素,其单质为N2,结构为N≡N,;XW为MgO,为离子化合物,电子式为
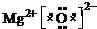
,Z为Fe元素,原子序数为26,位于元素周期表中第四周期,第VIII族,
故答案为:N≡N;
;第四周期,第VIII族.
(2)U为C元素,形成的单质有金刚石、石墨和C60等,分别属于原子晶体、混合晶体、分子晶体,故答案为:①③;
(3)U、V、W形成的10电子氢化物分别是CH4、NH3、H2O,NH3含有氢键,沸点比甲烷的沸点高,NH3的水溶液呈碱性,与水比较更易结合H+,可用NH3+H3O+=NH4++H2O的反应来证明,
故答案为:CH4;NH3;NH3+H3O+=NH4++H2O;
(4)SO2具有较强还原性,可用强氧化性物质HNO3发生氧化还原反应,生成硫酸,加入氯化钡生成硫酸钡沉淀,反应的离子方程式为3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+3Ba2++2H2O+2NO3-=3BaSO4↓+2NO↑+4H+.
本题解析:
本题难度:一般
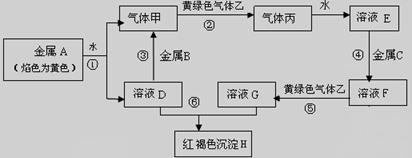
2、填空题 (8分)现有常见金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。其中B是地壳中含量居第一的金属元素。
请回答下列问题:
⑴写出金属B和气体丙的化学式?、?。
⑵写出反应①的化学反应方程式?。
⑶写出反应⑥的离子方程式?。
参考答案:(1)Al? HCl?(2)2Na+2H2O=2NaOH+H2↑?(3)? Fe3++3OH-=Fe(OH)3↓
本题解析:本题属于无机框图题,关键是找准突破点。B是地壳中含量居第一的金属元素,所以B是铝,根据A的焰色反应显黄色可知,A是钠。钠溶于水生成氢气和氢氧化钠,即甲是氢气,D是氢氧化钠。黄绿色气体应该是氯气,则丙就是氯化氢。红褐色沉淀应该是氢氧化铁,所以G是氯化铁,则F是氯化亚铁,所以C是铁。
本题难度:一般
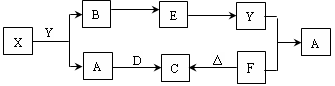
3、填空题 下图所示物质中,只有X是单质,常温下A和B呈气态,且B是导致酸雨的大气污染物,D是淡黄色固体。
据此回答下列问题:
(1)元素X在元素周期表中位于?周期?族。
(2)物质D的电子式为?,其阴阳离子个数比为?。
(3)请列举物质F的两种用途:?、?。
(4)写出X和Y反应的化学方程式?;若生成的B在标准状况下的体积为22.4L,则反应中转移电子数目为?。
(5)请写出Y和F反应的离子方程式?。
参考答案:(1)二;IVA
(2)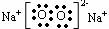 ;1︰2
;1︰2
(3)用作发酵粉、治疗胃酸过多等(只要合理即可)
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;1.204×1024
CO2↑+2SO2↑+2H2O;1.204×1024
(5)H++HCO3-=CO2↑+H2O
本题解析:随着全球气候大会的召开,在近期各地一模和二模的试题中,和气候有关的试题越来越多,本题是结合SO2对大气的危害和重要的化工反应、中学重要化学反应,并结合生活实际的一道无机推断题。考查的知识面比较广,试题综合性强。符合高考命题要求,是一道比价理想的试题。
根据题中描述可知B是SO2,且X是单质,A是气体,可以确定X、A和Y分别为C、CO2和H2SO4;结合D是淡黄色固体,并结合框图可确定D、C、F分别为Na2O2、Na2CO3和NaHCO3。据此可以做答。根据碳的原子结构为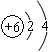 ,可确定其在第二周期第IVA族;结合Na2O2的电子式可确定阴阳离子个数比为1︰2。根据C和浓H2SO4的反应及化合价变化,可确定生成1mol SO2时转移2mol电子。
,可确定其在第二周期第IVA族;结合Na2O2的电子式可确定阴阳离子个数比为1︰2。根据C和浓H2SO4的反应及化合价变化,可确定生成1mol SO2时转移2mol电子。
本题难度:一般
4、推断题 下图所涉及的物质均为中学化学中常见的物质,其中C能使带火星的木条复燃,D为黄绿色气体,E为无色气体,其余为化合物,它们存在如下的转化关系(反应中生成部分产物均已略去)。

(1)写出有关物质的化学式: B________________________、E_________________________。
(2)指出MnO2在相关反应中的作用:反应①中是___________,反应②中是__________。
(3)写出B→D、F+D→G+B的稀溶液的离子方程式:
_____________________________,_______________________________。
参考答案:(1)HCl;H2
(2)催化剂;氧化剂
(3)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
? Cl2+H2O =H++Cl-+HClO
本题解析:
本题难度:一般
5、简答题 A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:
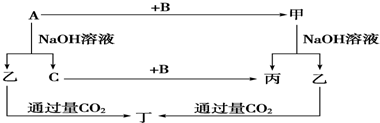
(1)写出下列物质的化学式.A______,B______,乙______,丁______.
(2)写出下列变化的化学方程式.
①A与NaOH溶液反应的化学方程式______.②甲与NaOH溶液反应的离子方程式______.
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为______,转移电子数目为______.
参考答案:常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,甲可能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,则:
(1)由上述分析可知,A为Al,B为O2,乙是NaAlO2,丁是Al(OH)3;
故答案为:Al,O2,NaAlO2,Al(OH)3;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)产生的H2在标准状况下的体积为3.36L,物质的量为3.36L22.4L/mol=0.15mol,根据2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,消耗的Al的物质的量为0.15mol×23=0.1mol,转移电子数目为0.1mol×3×NAmol-1=0.3NA;
故答案为:0.1mol,0.3NA.
本题解析:
本题难度:一般