微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列原料或制成的产品中,若出现破损不可以进行热修补的是
A.聚氯乙烯凉鞋
B.电木插座
C.自行车内胎
D.聚乙烯塑料膜
参考答案:B
本题解析:判断一种原料或制成的产品能否进行热修补,其要点是判断该物质加热是否可以熔融,从结构上认识即判断该物质是线型材料还是体型材料。对于A,其结构式为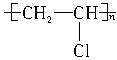 属于线型高分子化合物。对于C,其结构式为
属于线型高分子化合物。对于C,其结构式为
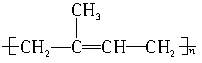 ,若硫化则可变为体型材料,结合生活实际,可知车辆内胎均可采用热补法(亦可以从自行车内胎具有弹性上,判断该物质为线性材料)。对于B,酚醛树脂既可以形成线型高分子材料(具有弹性),也可形成体型高分子材料(不具有弹性),而电木插座不具有弹性,则应为体型高分子材料。
,若硫化则可变为体型材料,结合生活实际,可知车辆内胎均可采用热补法(亦可以从自行车内胎具有弹性上,判断该物质为线性材料)。对于B,酚醛树脂既可以形成线型高分子材料(具有弹性),也可形成体型高分子材料(不具有弹性),而电木插座不具有弹性,则应为体型高分子材料。
本题难度:困难
2、选择题 有关键能数据如表:
A.423、3
B.460
C.920
D.1165、2
参考答案:B
本题解析:正确答案:B
△H=反应物键能之和减去生成物键能之和
=2×176 kJ·mol-1+498.8 kJ·mol-1―4X=△H= —989、2 kJ·mol-1
X= 460kJ·mol-1
本题难度:一般
3、选择题 下列仪器和装置,用橡胶管经过简单连接,可制备收集多种不同的气体(暂不考虑尾气吸收).关于这些装置的连接,下列说法正确的是

A.制备收集C2H4:连接a→d→f
B.制备收集NO2,连接a→c→f
C.制备收集H2S,连接b→c→e
D.制备收集NH3,连接b→d→e
参考答案:D
本题解析:分析:A.实验室制备乙烯所用的原料为乙醇,浓硫酸作催化剂、脱水剂,反应条件是加热到170℃,据此选择实验装置;
B.实验室制备NO2,所用的原料为铜和浓硝酸,反应生成硝酸铜、二氧化氮和水,据此选择实验装置;
C.实验室制备H2S,所用的原料为硫化亚铁(FeS)固体和稀盐酸,反应生成氯化亚铁和硫化氢,据此选择实验装置;
D.实验室制备NH3,可用浓氨水和CaO固体反应,反应生成氢氧化钙和氨气,据此选择实验装置;
解答:A.实验室制备乙烯,利用乙醇在浓硫酸的催化作用下发生分子内脱水制取乙烯,乙醇发生了消去反应:CH3CH2OH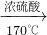 CH2=CH2↑+H2O,所以需温度计测在反应混合物中测量反应的温度,否则发生其它副反应,所以连接a→d→f无法制备,故A错误;
CH2=CH2↑+H2O,所以需温度计测在反应混合物中测量反应的温度,否则发生其它副反应,所以连接a→d→f无法制备,故A错误;
B.实验室制备NO2,利用铜和浓硝酸反应生成硝酸铜、二氧化氮和水,方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,反应无需加热,所以不能选择a装置,二氧化氮和水反应生成一氧化氮和硝酸,所以二氧化氮不能用排水法收集,所以连接a→c→f无法制备,故B错误;
C.实验室制备H2S,利用硫化亚铁(FeS)固体和稀盐酸反应生成氯化亚铁和硫化氢,其化学方程式为 FeS+2HCl═FeCl2+H2S↑,制取H2S的反应物为固体和液体反应不需要加热,可选择b装置,但硫化氢具有还原性,浓硫酸具有强氧化性,两者发生氧化还原反应,H2S+H2SO4(浓)=SO2+S↓+2H2O,所以不能选C装置,所以连接连接b→c→e无法制备,故C错误;
D.实验室制备NH3,可用浓氨水和CaO固体反应,NH3?H2O+CaO═Ca(OH)2+NH3↑,浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,制得氨气,可选择b装置,制得的氨气中含有水蒸气,可用碱石灰干燥,氨气密度比空气小,需用向下排空气法收集,所以需短管进,长管出,所以连接b→d→e可制备收集氨气,故D正确;
故选D.
点评:本题主要考查了实验室制备乙烯、NO2、H2S、NH3,掌握它们的制备原理是解答的关键,题目难度中等.
本题难度:困难
4、选择题 NA为阿伏加德罗常数,且已知C2H2(g)+?5/2O2(g)=2CO2(g)+H2O?(l)△H=-1300kJ·mol-1,?则下列说法正确的是
A.当有20NA个电子转移时,放出2600kJ 热量
B.当有4 NA个碳氧共用电子对生成时,放出1300kJ热量
C.若生成NA个水蒸气分子焓变为△H’,则△H’<△H
D.上述反应为吸热反应
参考答案:A
本题解析:考查阿伏加德罗常数的有关计算和判断。根据方程式可知,放出1300kJ的热量,转移电子的物质的量是5/2×4=10mol,所以如果转移20mol电子,则放出2600kJ的热量,A正确;放出1300kJ的热量时,共有8mol碳氧共用电子对生成,B不正确;由于气态水的能量高于液态水的能量,所以乙炔完全燃烧生成液态水放出的能量多,放热越多,△H越小,C不正确;该反应是放热反应,D不正确,答案选A。
本题难度:一般
5、选择题 在同温同压下,将3.2 g硫粉分别于纯氧中和空气中完全燃烧,设放出的热量分别为Q1、Q2,则关于Q1和Q2的大小判断正确的是
A.Q1>Q2
B.Q1<Q2
C.Q1=Q2
D.无法判断
参考答案:B
本题解析:根据盖斯定律,放出的热量应相等,但应考虑S燃烧时在纯氧中比与空气中燃烧的火焰更明亮,所以释放的光能大,部分能量以光能释放,所以释放的热量就偏小.
本题难度:困难