微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:

(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
参考答案:⑴4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O(2分)
⑵①酚酞(2分)溶液由无色恰好变成浅红色且在半分钟内不褪色(2分)
②96.2%(2分)
本题解析:(1)甲酸与碳酸钾反应生成二甲酸钾酸式盐,根据质量守恒定律,产物中还有二氧化碳、水,所以化学方程式为4HCOOH+K2CO3=2KH(HCOO)2+CO2↑+H2O;
(2)①终点时氢氧化钠与二甲酸钾恰好完全反应生成正盐,甲酸是弱酸,所以其正盐水解溶液为碱性,故使用在碱性条件下变色的酚酞做指示剂;终点的现象是溶液由无色恰好变成浅红色且在半分钟内不褪色;
②二甲酸钾与氢氧化钠溶液反应的化学方程式为2KH(HCOO)2+ 2NaOH=K2(HCOO)2 +Na2(HCOO)2+2H2O,则n(KH(HCOO)2)=" n(NaOH)=" 18.50×10-3L×0.10mol/L=1.85×10-3mol,所以
产品中二甲酸钾的质量分数为1.85×10-3mol×130g/mol×10÷2.5g×100%=96.2%。
考点:考查化学反应的判断,质量分数的计算,滴定实验现象的判断及指示剂的选择
本题难度:困难
2、填空题 稀氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
已知,25℃时溶液中存在下列关系:K=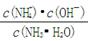 =1.8×10-5
=1.8×10-5
(1)向稀氨水中通入氨气时,平衡向 移动(用“右”、“左”填空,下同),向稀氨水中加入氢氧化钠时,平衡向 移动。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,所得溶液pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向氨水中加入少量(NH4)2SO4固体,此时溶液中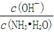 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(3)25℃时,若氨水的起始浓度为0.5 mol/L,平衡时溶液中c(OH-)=__________________,pH=______;向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)= 。
参考答案:(共13分)
(1)右 (1分) 左 (1分)
(2)< (1分) NH4++H2O NH3·H2O+H+(2分) 减小(2分)
NH3·H2O+H+(2分) 减小(2分)
(3)3×10-3 mol/L(2分) 11.5 (2分) a/2 mol/L(2分)
本题解析:(1)通入氨气,c(NH4+)增大,c(OH-)增大,平衡向右移动。加入氯化铵固体,铵根离子浓度增大,平衡向左移动。
(2)氯化铵是强酸弱碱盐,水解呈酸性,pH<7,离子方程式为NH4++H2O NH3·H2O+H+。向氨水中加入少量(NH4)2SO4固体,水解平衡正向移动,故
NH3·H2O+H+。向氨水中加入少量(NH4)2SO4固体,水解平衡正向移动,故 减小。
减小。
(3)K=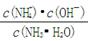 =1.8×10-5。c(OH-)=)3×10-3 mol/L。pH=11.5。向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)=a/2 mol/L。
=1.8×10-5。c(OH-)=)3×10-3 mol/L。pH=11.5。向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)=a/2 mol/L。
考点:弱电解质在水溶液中的电离平衡
点评:本题考查了电离平衡的移动,根据勒夏特列原理进行分析解答即可,难度不大。
本题难度:一般
3、选择题 某Na2CO3溶液的pH可能是
A.5
B.6
C.7
D.8
 固体,故A错误;阴极反应为
固体,故A错误;阴极反应为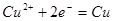 ,当有0.2 mol电子转移时阴极会析出6.4g铜,故B错误;用酸式滴定管量取高锰酸钾溶液,故C错误;加热,水的电离平衡正向移动,Kw增大,pH变小,故D正确。
,当有0.2 mol电子转移时阴极会析出6.4g铜,故B错误;用酸式滴定管量取高锰酸钾溶液,故C错误;加热,水的电离平衡正向移动,Kw增大,pH变小,故D正确。