微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在一定温度和压强下,有如下反应:2SO2(g)+O2 (g)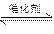 ?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
(1)达平衡时混合气体的体积为___________,SO2的转化率为___________;
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120 L。则a、b的值分别为:a=_________,b=_________;
(3)若容器为体积不变的密闭容器,其容积为100 L。起始时加入x mol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同。则x、y应该满足的关系式为________,x、z应该满足的关系式为_____________。
参考答案:(1)80 L 60%(2)? 2.4? 1.2
(3)x∶y=2∶1x+z=2
本题解析:(1)反应前后,气体总质量不变,则平衡时V(总)=
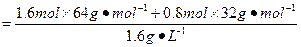 ="80" L。
="80" L。
2SO2(g)? +? O2 (g) 2SO3(g)
2SO3(g)
起始:1.6 mol? 0.8 mol? 0
转化:2x? x? 2x
平衡:1.6-2x? 0.8-x? 2x
因为: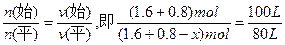 ,故x="0.48" mol,n(平)="1.92" mol。
,故x="0.48" mol,n(平)="1.92" mol。
α(SO2)=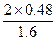 ×100%=60%
×100%=60%
(2)当保持温度、压强不变时,按n(SO2)∶n(O2)=2∶1通入a mol SO2和b mol O2,建立起等效平衡,则α(SO2)不变。因为a=2b,所以n(SO2)=2b。在(1)中n(平)="1.92" mol,在(2)时达到平衡时:
2SO2(g)+O2(g) 2SO3(g)?Δn
2SO3(g)?Δn
2? 1
2b·60%? 0.6b
n2(平)=3b-0.6b=2.4b
又知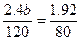 ,所以b=1.2,a=2.4
,所以b=1.2,a=2.4
(3)中x∶y=2∶1,x+z=2。
本题难度:简单
2、选择题 从下列实验事实所引起的相应结论不正确的是( )
| 选项 | 实? 验? 事? 实 | 结? 论
?
A
其它条件不变,0.01mol/L的KMnO4酸性溶液分别与0.1mol/L的H2C2O4溶液和0.2mol/L的H2C2O4溶液反应,后者褪色时间短.
当其它条件不变时,增大反应物浓度可以使化学反应速率加快
?
B
其它条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊.
当其它条件不变时,反应体系的温度越高、化学反应速率越快
?
C
将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变.
催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程
?
D
一定条件下,分别在容积为1L和容积为2L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)?2HI(g),获得等量HI时需要的时间前者少.
当其它条件不变时,气态反应体系的压强越大、化学反应速率越快
|
A.A
B.B
C.C
D.D
参考答案:A、草酸浓度大,反应速率快,反应需要的时间短,浓度增大会加快反应速率,故A正确;
B、温度变化一定对反应速率影响,升温,速率增大,降温反应速率减小;Na2S2O3溶液和H2SO4混合液在热水中浑浊现象快,反应速率快,故B正确;
C、催化剂改变化学反应速率,不改变化学平衡,催化剂在反应前后质量和化学性质不变,催化剂参与反应过程,降低活化能,故C错误;
D、对有气体的反应,压强增大会增大化学反应速率,故D正确;
故选C.
本题解析:
本题难度:简单
3、选择题 对于可逆反应mA(g)十nB(g) pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
pC(g)十qD(g),若其它条件都不变,探究催化剂对反应的影响,可得到如下两种v-t图象。下列判断正确的是
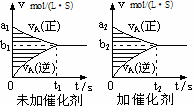
A.b1>b2,t1>t2
B.两图中阴影部分面积一定相等
C.A的平衡转化率(II)大于(Ⅰ)中A的转化率
D.若m+n<p+q,则压强变化对正反应速率的影响程度比逆反应速率影响程度大
参考答案:B
本题解析:对于任何化学反应来说,加入催化剂,能提高化学反应速率,缩短达到平衡所需要的时间。但是不能使化学平衡发生移动。因此,b2> b1,t1>t2。A错误。达到平衡时物质的浓度改变数值相等。Δc=Δv·Δt不变。即两图中阴影部分面积相等。B正确。C.由于催化剂不能是平衡发生移动,所以A的平衡转化率(II)等于(Ⅰ)中A的转化率。错误。D. 该反应的正反应为气体体积减小的反应。增大压强使平衡逆向移动;减小压强,平衡正向移动。既压强对逆反应速率的影响程度比正反应速率影响程度大。错误。
本题难度:一般
4、选择题 少量铁片与l00 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③④⑥⑦⑧
参考答案:C
本题解析:①加水,盐酸浓度降低,反应速率减慢,错误;②加KNO3溶液,由于溶液中有硝酸存在,则产生氢气的量减少,错误;③滴入几滴浓盐酸,使溶液中氢离子浓度增大,反应速率加快,铁的质量固定,所以产生氢气的量不变,正确;④加入铁粉,与盐酸的接触面积增大,反应速率加快,但铁的质量增加,氢气的量则增加,错误;⑤加NaCl溶液,与加水相同,反应速率减慢,错误;⑥加硫酸铜溶液,铁置换铜,与铜形成原电池,加快反应速率,但铁的质量减少,产生的氢气减少,错误;⑦升高温度,反应速率加快,氢气的量不变,正确;⑧盐酸浓度增大,氢离子物质的量不变,所以反应速率加快,氢气的量不变,正确,答案选C。
本题难度:一般
5、选择题 图为某化学反应速率一时间图。在 时刻升高温度或增大压强,都符合下图所示变化的反应是
时刻升高温度或增大压强,都符合下图所示变化的反应是

A.2SO2(g)+O2(g) 2SO3(g);ΔH<0
2SO3(g);ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);ΔH<0
4NO(g)+6H2O(g);ΔH<0
C.H2(g)+I2(g) 2HI(g); ΔH>0
2HI(g); ΔH>0
D.C(s)+H2O(g) CO(g)+H2(g) ;ΔH>0
CO(g)+H2(g) ;ΔH>0
参考答案:B
本题解析:由图可知:增大压强或升高温度,正反应、逆反应的速率都增大,但逆反应速率增大的多,化学平衡逆向移动。根据勒夏特列原理,增大压强,化学平衡向气体体积减小的方向移动。升高温度,化学平衡向吸热方向移动。即该反应的逆反应是气体体积减小的吸热反应。正反应是气体体积扩大的放热反应。A 正反应是气体体积减小的反应,错误。B正反应是气体体积扩大的放热反应。正确。C反应是等体积反应,错误。D正反应是吸热反应,错误。
本题难度:一般