微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 NaHA是二元酸H2A的酸式盐,下列说法正确的是
A.若NaHA的水溶液呈酸性,则二元酸H2A一定是强酸
B.若NaHA的水溶液呈碱性,则HA-只发生水解
C.无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都是1︰1
D.无论H2A是强酸还是弱酸,NaHA晶体中的阴阳离子个数比都是1︰l
参考答案:D
本题解析:A不一定,NaHA的水溶液呈酸性,并不能说明该盐不水解。弱酸的酸式盐既存在电离平衡,还存在水解平衡,B不正确。无论H2A是强酸还是弱酸,NaHA溶液中Na+和HA-的个数之比都不是1︰1,C不正确。所以正确的答案是D。
本题难度:简单
2、选择题 向1 L 0.3 mol·L-1的NaOH溶液中缓慢通入CO2气体至溶液增重8.8 g(忽略体积变化),下列说法中不正确的是
A.所得溶液呈碱性
B.取20mL所得溶液,甲基橙做指示剂,用0.2 mol·L-1的HCl 进行滴定,消耗HCl的体积为10mL
C.c(Na+) + c(H+) =" 2" c(CO32-) + c(HCO3-) + c(OH?-)
D.2c(Na+) = 3[c(CO32-) + c(HCO3-) + c(H2CO3)]
参考答案:B
本题解析:略
本题难度:一般
3、选择题 下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的NaHA溶液pH=1,则有:c(Na+)=c(H2A)+c(HA-)+c(A2-)
参考答案:C
本题解析:A项,亚硫酸氢根离子电离生成氢离子和亚硫酸根离子,水存在微弱的电离生成氢离子和氢氧根离子,所以氢离子浓度大于亚硫酸根离子浓度,A错;B项,相同浓度的CH3COONa和Na2CO3溶液,CH3COO-的水解程度小于CO32-的水解程度,所以pH相同的CH3COONa和Na2CO3溶液:c(CH3COONa)>c(Na2CO3);C项,根据电荷守恒得c(M+)+c(H+)=c(A-)+c(OH-),由于溶液呈中性,则c(H+)=c(OH-),所以c(M+)=c(A-);D项,0.1 mol·L-1的NaHA溶液pH=1,则NaHA=Na++H++A2-,所以溶液中不存在HA-和H2A。
本题难度:一般
4、选择题 在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O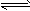 HCO3-+OH-。下列说法中,正确的是
HCO3-+OH-。下列说法中,正确的是
[? ]
A.升高温度,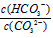 减小
减小
B.通入CO2,平衡向正反应方向移动
C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大
D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小
参考答案:B
本题解析:
本题难度:一般
5、填空题 (共13分)
(1)、(2分)物质的量浓度均为0.1 mol/L的下列溶液: ①KNO3、 ②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦NH4Cl,pH 由大到小的顺序为(填序号)?
(2)、(2分)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是?________??
(3)、下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性(9分)
K 2CO3??溶液呈?性;
Na2SO4??溶液呈?性;
CuCl2?溶液呈?性;
参考答案:

本题解析:略
本题难度:简单