微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 检验HCl气体中是否混有Cl2,可采用的方法是?(? )
A.用干燥的蓝色石蕊试纸
B.用干燥的有色布条
C.将气体通入AgNO3溶液中
D.用湿润的淀粉碘化钾试纸
参考答案:D
本题解析:A 、B 错误,因为纸条或布条是干燥的,不会反应。
C 错误,HCl气体也可以使AgNO3溶液产生白色沉淀。
D 正确,Cl2能使湿润的淀粉碘化钾试纸变蓝,HCl不能。
本题难度:简单
2、填空题 亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:

(1)A的化学式是??,装置III中A在?极区产生。
(2)II中反应的离子方程式是?。
(3)通电电解前,检验III中阴离子的方法和步骤是?。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 ??(填字母编号)。
a.Na2O2?b.FeCl2?c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07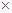 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中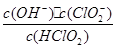 = ?。
= ?。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是 ?
参考答案:(1)H2SO4?(2分)?阳(2分)
(2)2ClO2+H2O2+2OH-=2ClO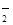 +O2↑+2H2O (3分)
+O2↑+2H2O (3分)
(3)取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶
液,产生白色沉淀,证明含有SO42-?(3分)
(4)a(2分)
(5)1.07×1010mol·L-1 (3分)
(6)c(H+)>c(SO42-)>c(Cu2+)>c(OH-) (3分)
本题解析:(1)Ⅲ为电解硫酸钠溶液,本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,另一电极产生NaOH,因为该电解池为离子隔膜电解池,所以A为硫酸,在阳极区产生。
(2))Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,HCl是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应方程式为:2NaOH+2ClO2+H2O2=2?NaClO2+2H2O+O2↑,离子方程式是2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O。
(3)III中阴离子为SO42?,检验方法为:取少量Ⅲ中溶液少许于试管中,先加入足量稀盐酸,无沉淀生成,再加入BaCl2溶液,产生白色沉淀,证明含有SO42- ?
(4)加入FeCl2和Na2S会产生杂质,而Na2O2不会产生新的杂质,故a项正确。
(5)II中反应所得NaClO2溶液(含少量NaOH)的pH=13,可得c(H+)=1×10-13mol?L?1,则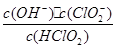 =
=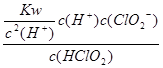 =1.07×1010mol·L-1 。
=1.07×1010mol·L-1 。
(6)电解硫酸铜溶液的化学方程式为:2CuSO4+2H2O 2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
2H2SO4+2Cu+O2↑,生成铜3.2 g,则反应了CuSO4的物质的量为0.05mol,生成H2SO4的物质的量为0.05mol,则所得溶液含0.05mol的CuSO4和0.05mol的H2SO4,Cu2+水解生成H+,所以离子浓度由大到小的顺序为:c(H+)>c(SO42-)>c(Cu2+)>c(OH-)。
本题难度:困难
3、填空题 某化学兴趣小组在实验室利用氯气与石灰乳【Ca(OH)2】制取漂白粉.
已知2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O
该兴趣小组设计了下列实验装置,进行如下实验:
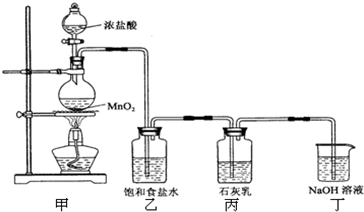
请回答下列问题:
(1)实验室用甲装置用于制备氯气,其反应的化学方程式是______;
(2)工业上电解饱和食盐水来制备氯气,其化学方程式是______;
(3)乙装置的作用是______,丁装置的作用是______.
(4)该兴趣小组用足量的浓盐酸与8.7g?MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2______g.但小组成员发现,实际上产物中Ca(ClO)2的质量明显小于理论值.为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应;温度较高时,氯气和碱还能发生如下反应:6Cl2+6Ca(OH)2
?5CaCl2+Ca(ClO3)2+6H2O
(5)为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:______.
参考答案:(1)实验室制取氯气是用浓盐酸和二氧化锰发生氧化还原反应生成氯化锰、氯气和水,反应的化学方程式为:
MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
(2)工业上电解饱和食盐水来制备氯气,是氯化钠和水在通电条件下电解反应生成氢氧化钠、氯气和氢气,反应的化学方程式为:2NaCl+2H2O?通电?.?H2↑+Cl2↑+2NaOH;
故答案为:2NaCl+2H2O?通电?.?H2↑+Cl2↑+2NaOH;
(3)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;烧杯中的氢氧化钠溶液是吸收过量氯气,避免排放到空气中污染环境,进行尾气处理;
故答案为:除去Cl2中混有的HCl气体;进行尾气处理;
(4)足量的浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2;可以依据反应MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量关系:8.7g MnO2物质的量为0.1mol;
2MnO2~Ca(ClO)2
2? 1
0.1mol? 0.05mol
所以理论上最多可制得Ca(ClO)2 质量=0.05mol×143g/mol=7.15g;故答案为:7.15;
(5)依据(4)中 信息反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生反应,6Cl2+6Ca(OH)2?△?.? 5CaCl2+Ca(ClO3)2+6H2O;
故答案为:将丙装置置于装有冷水的容器中;
本题解析:
本题难度:一般
4、选择题 用氯气消毒的自来水配制下列溶液,会使配得的溶液变质的是(? )
①NaOH;②AgNO3;③Na2CO3;④FeCl2
A.只有②③
B.只有③④
C.只有①②③④
D.只有②③④
参考答案:C
本题解析:氯气溶于水生成盐酸和次氯酸,具有酸性和氧化性,因此与四种物质都是反应的,所以均失效,答案选C。
点评:该题是中等难度的试题,试题注重基础,兼顾能力的培养。该题的关键是明确氯水中的微粒,以及相应微粒的性质,然后结合题干信息灵活运用即可,有助于培养学生的逻辑推理能力。
本题难度:一般
5、选择题 a、b、c、d四个集气瓶中分别装有Cl2、H2、HCl、HBr的任一种气体,若a、b两瓶气体混合见光爆炸,a、d两瓶气体混合瓶壁上出现暗红色小液滴,则c瓶装的气体是
A.HBr
B.HCl
C.Cl2
D.H2
参考答案:B
本题解析:a、b两瓶气体混合见光爆炸,说明是Cl2、H2两种气体,a、d两瓶气体混合瓶壁上出现暗红色小液滴,说明是Cl2和HBr混合生成了液溴(Br2)之故.由此a为公共气体Cl2,则b为H2,d为HBr,余下气体为HCl气体,必为c瓶气体.
本题难度:简单