微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)完成下列物质的电子式
A.H______,B.Na+______,C.Cl-______,D.H2O______,E.KOH______.
(2)用电子式表示下列化合物:
H2S:______;MgCl2:______;NH4Cl:______.
参考答案:(1)A、氢原子最外层有1个电子,电子式为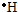 ,故答案为:
,故答案为: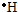 ;
;
B、钠离子为简单阳离子,离子符号即为电子式,故答案为:Na+;
C、氯离子为阳离子,最外层为8电子稳定结构,电子式为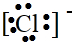 ,故答案为:
,故答案为: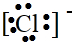 ;
;
D、水分子中氧原子与2个氢原子共用2对电子对,电子式为 ,故答案为:
,故答案为: ;
;
E、KOH是离子化合物,电子式为: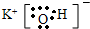 ,故答案为:
,故答案为: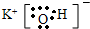 ;
;
(2)硫化氢中硫原子与2个氢原子共用2对电子对,电子式为 ,故答案为:
,故答案为: ;
;
氯化镁为离子化合物,电子式为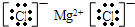 ,故答案为:
,故答案为: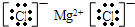 ;
;
氯化铵为离子化合物,电子式为: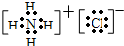 ,故答案为:
,故答案为: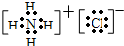 .
.
本题解析:
本题难度:简单
2、简答题 A~E是原子序数依次增大的五种短周期元素,其有关性质或结构信息如表所示:
| 元素 | A | B | C | D | E
有关性质或结构信息
单质是空气中主要成分之一,其氢化物水溶液呈碱性
原子核外有两个未成对电子
日常生活中常见的金属,通常用电解法冶炼其单质
其简单阴离子带两个单位负电荷
单质有毒,常温下为有色气体,常用于自来水消毒
|
请结合表中信息完成下列各小题:
(1)C在元素周期表中的位置是______,D的简单阴离子的核外电子排布式为______.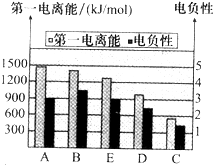
(2)如图是A~E的第一电离能和电负性数据,请回答:
①E的第一电离能大于D,其原理是(根据它们在周期表中的位置解释)______.
②A、B、D三种元素的非金属性由强到弱的顺序是______.
(3)A的常见单质分子有多个共价键.
①常温下,该单质化学性质很稳定,是因为______.
②该单质分子中σ键与π键的数目之比为______.
(4)写出C、E形成的化合物与A的氢化物在水溶液中反应的离子方程式______.
参考答案:A~E是原子序数依次增大的五种短周期元素,A单质是空气中主要成分之一,其氢化物水溶液呈碱性,则A为氮元素;B原子核外有两个未成对电子,则B的外围电子排布为ns2np2或ns2np4,原子序数大于氮元素小于Al元素,处于第二周期,故B为氧元素;C是日常生活中常见的金属,通常用电解法冶炼其单质,则C为Al元素;D元素简单阴离子带两个单位负电荷,处于ⅥA族,原子序数大于Al元素,故D为硫元素;E元素单质有毒,常温下为有色气体,常用于自来水消毒,故E为Cl元素,
(1)C为Al元素,原子核外有3个电子层,最外层电子数为3,处于周期表中第3周期ⅢA族;硫离子的核外电子排布式为1s22s22p63s23p6,
故答案为:第3周期ⅢA族;1s22s22p63s23p6;
(2)①由图可知,同一周期由左到右第一电离能逐渐增大,故Cl元素的第一电离能较大,
故答案为:同一周期由左到右第一电离能逐渐增大;
②电负性越大,非金属性越强,由可知,电负性B>A>D,故非金属性B>A>D,
故答案为:B>A>D;
(3)①氮气分子中存在氮氮叁键,氮氮叁键的键能很大,氮气的化学性质稳定,
故答案为:氮氮叁键的键能很大;
②N≡N三键中含有1个σ键、2个π键,故氮气分子中σ键与π键数目之比为1:2,
故答案为:1:2;
(4)氯化铝与氨水反应生成氢氧化铝与氯化铵,反应离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
本题解析:
本题难度:一般
3、选择题 下列物质中含有的化学键仅为极性共价键的是( ? )
A.CH4
B.NaOH
C.I2
D.Ar
参考答案:A
本题解析:
本题难度:一般
4、填空题 ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
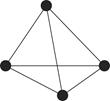
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。
(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
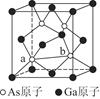
参考答案:(1)N>P>As
(2)3s23p63d10
(3)CO2或CS2或N2O(任写一种,写成SiO2等原子晶体形式不正确)
(4)sp3
(5)①V形或角形或折线形
②6
(6)是
(7)
 c(说明:如图所示,平行四边形abcd中ab=cd=
c(说明:如图所示,平行四边形abcd中ab=cd= c)
c)
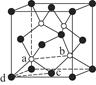
本题解析:(1)同一主族元素的原子半径越大,越易失去电子,电离能越小。(3)等电子体指原子总数相等,价电子总数相等的粒子。(4)白磷分子中每个P原子有一个孤电子对,形成了3个σ键,故采取sp3杂化。(5)NO2-中氮原子的孤电子对数为 (5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,NO2-为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×
(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,NO2-为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8× +6×
+6× =4,则晶体密度为
=4,则晶体密度为 =
= ?g·cm-3=
?g·cm-3= g·cm-3。
g·cm-3。
本题难度:一般
5、选择题 X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成离子化合物Z,下列说法中不正确的是
[? ]
A.Z在熔化状态下可以导电
B.Z可以表示为XY2
C.X形成+2价阳离子
D.Z中存在共价键,Z可以电离
参考答案:D
本题解析:
本题难度:简单