微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 8.下列物质溶于水电离出的Cl—数目与2molNaCl溶于水电离出的Cl—数目相同的是(?)
A.1molAlCl3
B.2molKClO3
C.1molMgCl2
D.1.5molCaCl2
参考答案:C
本题解析:2mol氯化钠中氯离子的物质的量是2mol,A中溶于水电离出的氯离子是3mol,B不能电离出氯离子,C电离出的氯离子是2mol,D是1.5mol×2=3mol,所以答案选C。
本题难度:一般
2、选择题 用于配制一定物质的量浓度的溶液的实验装置是( )
A.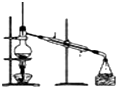
B.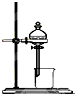
C.
D.
参考答案:A、这个装置是实验室蒸馏装置,不是配制一定物质的量浓度溶液的装置,故A错误;
B、此装置是萃取装置,不是配制一定物质的量浓度的溶液装置,故B错误;
C、该装置是过滤装置,不是配制一定物质的量浓度的溶液的装置,故C错误;
D、该装置是配制一定物质的量浓度的溶液的装置,故D正确;
故选D.
本题解析:
本题难度:一般
3、填空题 将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进行蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:
组 别
| 1
| 2
| 3
|
盐酸体积(mL)
| 50
| 50
| 50
|
A的质量(g)
| 3.80
| 5.70
| 7.60
|
气体体积(mL)
| 896
| 1344
| 1344
|
(1)上表中第 组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为 mol·L-1
参考答案:(6分,每空2分) (1)第(1)组 (2)A的成份为 Na2CO3与NaHCO3 (3)1.8
本题解析:(1)①~③组所用盐酸的物质的量相同,而第①组生成的气体比其他两组都少,所以第1组盐酸过量,即故答案选①。
(2)第①组中,n(CO2)=0.896L÷22.4L/mol==0.04mol。
如全部为Na2CO3,则m(Na2CO3)=106g/mol×0.04mol=4.2g
如全部为NaHCO3,则m(NaHCO3)=84g/mol×0.04mol=3.36g,
所以应为Na2CO3与NaHCO3的混合物,故答案为Na2CO3与NaHCO3。
(3)由第②组可知,盐酸和A完全反应,设混合物中含有xmolNa2CO3,ymolNaHCO3,
则106x+84y=5.70、x+y=1.344÷22.4
解得x=y=0.03mol
所以根据元素守恒可知
n(HCl)=n(Na+)=2×n(Na2CO3)+n(NaHCO3)
=2×0.03mol+0.03mol
=0.09mol
所以c(HCl)=0.09mol÷0.05L
=1.8mol/L
考点:考查碳酸钠和碳酸氢钠混合物与盐酸反应得有关判断和计算
点评:该题是中等难度试题的考查,侧重对学生能力的培养。该题的关键是明确反应的原理,然后结合对表中数据的分析,借助于数学中的讨论法进行即可。有利于培养学生的逻辑推理能力和创新思维能力以及数据的分析能力,提高学生的应试能力。
本题难度:困难
4、简答题 (1)下面A~F是中学化学实验中常见的几种仪器:
A.坩埚 B.容量瓶 C.试管 D.托盘天平 ?E.玻璃棒
①其中仪器上标示出仪器的使用温度的______(填写编号);
②称取?10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为______?g.
(2)若要配制500mL?1mol/L?NaOH溶液时,下列哪些操作会使实验结果偏高的是______,偏低______,无影响______.(填写编号)
A.定容,振荡,摇匀溶液后,发现液面低于刻度线,再补加水
B.称量时,固体放在右盘,砝码放在左盘(未使用游码)
C.原容量瓶洗涤后未干燥
D.定容时俯视刻度线
E.移液时,未洗涤烧杯和玻璃棒
F.在烧杯中溶解NaOH固体后,未冷却立即将溶液注入容量瓶中.
参考答案:(1)①液体的体积受温度的影响,温度不同时,容量瓶中的液体的体积不同,导致产生误差,故答案为:B;
②将样品放在了天平的右盘,则所称样品的实际质量为10g-0.5g=9.5g,故答案为:9.5g;
(2)A.定容,振荡,摇匀溶液后,发现液面低于刻度线,液面低于刻度线,一部分溶液留在瓶塞与瓶口之间,再加蒸馏水至刻度线,导致溶液体积偏大,所以溶液浓度偏低.
B.天平平衡原理为左盘内质量=右盘内质量+游码.称量时,固体放在右盘,砝码放在左盘,未使用游码,对物体的质量没有影响,故对溶液浓度无影响;
C.最后需要定容,原容量瓶洗涤后未干燥,对溶液浓度无影响;
D.俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高;
E.移液时,未洗涤烧杯和玻璃棒,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;
F.液体具有热胀冷缩的性质,氢氧化钠溶解放热,未冷却到室温,将溶液到入容量瓶,并配成了溶液,会导致溶液体积偏小,溶液浓度偏高.
所以偏高的有DF,偏低有AE,无影响的是BC,
故答案为:DF;AE;BC.
本题解析:
本题难度:一般
5、选择题 某氯原子的质量为a g , C-12原子的质量为b g,用NA表示阿伏加德罗常数,下列说法中不正确的是
A.则该氯原子构成氯分子的相对分子质量为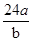
B.1 mol该氯原子的质量为aNA g
C.m g该氯原子的物质的量为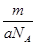 mol
mol
D.n g该氯原子所含的电子数为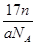
参考答案:D
本题解析:根据原子的相对原子质量等于该原子的质量比的C-12原子的质量的1/12,可以求算出A正确;摩尔质量的定义可知B、C正确;n g该氯原子的原子数为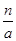 ,电子数为
,电子数为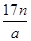 。
。
点评:正确理解物质的量、摩尔质量、相对原子质量是解决本题的关键。
本题难度:一般