微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某二价金属A与稀硝酸反应时,A与被还原的硝酸的物质的量之比为2:1,则硝酸被还原的产物是( )
A.NO2
B.NO
C.N2O
D.N2
参考答案:C
本题解析:略
本题难度:简单
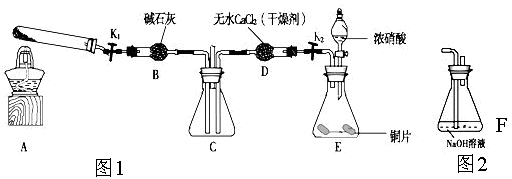
2、实验题 某化学课外活动小组通过实验研究NO2的性质。
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O
利用下图1所示装置探究NO2能否被NH3还原(K1,K2为止水夹.夹持固定装置略去)
 ?
?
(1)E装置中制取NO2反应的离子方程式是?。
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取?。
a.NH4HCO3? b.NH4Cl? c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是?。
(4)实验过程中气密性良好,但未能观察到C装置中的预期现象。该小组同学分析其原因可能是:
①;还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;
③?。
(5)此实验装置存在一个明显的缺陷是?。
(6)为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2。另选F装置(如图2所示),重新组装,进行实验。装置的合理连接顺序是____。实验过程中,B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成。推测B装置中反应的化学方程式为________________________________。
参考答案:(14分)(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O(2分) (2)a(2分)
(3)C装置中混合气体颜色变浅(其它合理答案酌情给分)(2分)
(4)在此条件下,该反应的化学反应速率极慢(未使用催化剂、未加热等答案合理即给分)(2分)
(5)缺少尾气吸收装置(2分)
(6)EDBF或FBDE(2分);2NO2+Na2O2=2NaNO3(2分)
本题解析:(1)浓硝酸具有强氧化性,能和铜反应生成硝酸铜、二氧化氮和水,反应的离子方程为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O。
(2)a、加热NH4HCO3时,碳酸氢铵分解生成氨气、水和二氧化碳,除去水和二氧化碳就可以得到氨气,故a正确;b、加热NH4Cl时,氯化铵分解生成氨气和氯化氢,但温度降低后,氨气和氯化氢又反应生成氯化铵,所以得不到氨气,故b不正确;c、浓氨水是液体,试管中的药品是固体,所以不符合要求,故c不正确,答案选a。
(3)二氧化氮是红棕色气体,如果能被氨气还原,生成无色气体氮气,则C装置中混合气体颜色变浅。
(4)未能观察到C装置中的预期现象,这说明反应未能发生或发生的反应物很少,因此造成未能观察到C装置中的预期现象可能原因是:在此条件下,该反应的化学反应速率极慢或未使用催化剂或未加热或NO2的转化率极低导致反应现象变化不明显。
(5)二氧化氮是有毒气体,氨气是有刺激性气味的气体,所以都不能直接排空,要进行尾气处理才能排空。
(6)验证过氧化钠和二氧化氮反应,首先要用E装置制取二氧化氮,因为制取的二氧化氮气体中含有水蒸气,水能和过氧化钠反应而造成干扰,所以要用D装置除去水蒸气,然后较纯净的二氧化氮通过B装置,未反应的二氧化氮有毒不能直接排空,所以最后要进行尾气处理,选用图2装置处理尾气,所以装置的合理连接顺序是EDBF或FBDE ;B装置中淡黄色粉末逐渐变成白色。经检验,该白色物质为纯净物,且无其他物质生成,过氧化钠作氧化剂,则二氧化氮中氮元素失电子化合价升高而作还原剂,所以氮元素只能转化为+5价,且生成物是纯净物,所以是硝酸钠,因此反应的化学方程式为2NO2+Na2O2=2NaNO3。2的性质;实验方案设计与评价;尾气处理以及氧化还原反应的有关判断和应用等
本题难度:困难
3、选择题 过量的Fe和一定量的稀硝酸完全反应,生成一氧化氮气体1mol,则参加反应的硝酸的物质的量为
A.2moL
B.3moL
C.4moL
D.5moL
参考答案:C
本题解析:过量的Fe和一定量的稀硝酸完全反应,反应的化学方程式为:
3Fe + 8HNO3===== 3Fe(NO3)2 + 2NO + 4H2O
4mol? 1mol
正确答案为C;
本题难度:一般
4、计算题 (8分)? 50mL 2mol/L的稀硝酸与1.92 g铜反应,铜完全溶解。求下列问题
(1)写出该反应的化学方程式?
(2)生成的气体在标况下的体积
(3)反应后,溶液中NO3-的物质的量浓度?(设反应前后溶液的体积不变)
参考答案:(1)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O (2)0.448L? (3)1.6mol/L
本题解析:(2)n(Cu)=" 1.92" g /64g.mol-1="0.03" mol? n(HNO3)=" 2mol/L×0.05L=0.1" mol
则铜耗尽,稀硝酸剩余
3Cu + 8HNO3 =3Cu(NO3)2+2NO↑+4H2O
3?2
0.03mol?n(NO)
3:2="0.03mol:" n(NO),得:n(NO)="0.02" mol
在标况下,V(NO)="0.02" mol×22.4 L.mol-1=0.448L
(3)利用“N”守恒,n余(NO3-)= n(HNO3)- n(NO)=" 0.1" mol-0.02 mol="0.08" mol
则C(NO3-)="0.08" mol/0.05L=1.6mol/L
本题难度:一般
5、选择题 将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况)。则所消耗硝酸的物质的量是(?)
A.0.12 mol
B.0.11 mol
C.0.09 mol
D.0.08 mol
参考答案:B
本题解析:考查氧化还原反应的有关计算。被还原的硝酸是1.12l÷22.4L/mol=0.05mol。生成硝酸铜是1.92g÷64g/mol=0.03mol,所以没有被还原的硝酸是0.06mol,因此消耗硝酸是
0.06mol+0.05mol=0.11mol,答案选B。
本题难度:一般