微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列关于反应热的说法正确的是(?)
A.在稀溶液中所有酸和碱反应的中和热数值都相等
B.已知C(s)+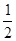 O2(g)="CO(g)" △H=-110.5kJ/mol,说明碳的燃烧热为-110.5kJ/mol
O2(g)="CO(g)" △H=-110.5kJ/mol,说明碳的燃烧热为-110.5kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关
参考答案:D
本题解析:中和热的数值与酸碱的强弱有关,A错。碳的燃烧热应对应生成二氧化碳,B错。需要加热才能发生的反应也可能是放热反应,如,煤的燃烧,C错。D正确。
本题难度:一般
2、填空题 (15分)二甲醚(DME)和甲醇是21世纪应用最广泛的两种清洁燃料,目前工业上均可由合成气在特定催化剂作用下制得。
(1)由合成气制备二甲醚的主要原理如下:
已知:①CO(g)+2H2(g) CH3OH(g)? △H1=-90.7 kJ·mol-1
CH3OH(g)? △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
则反应3H2(g)+3CO(g)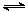 CH3OCH3(g)+CO2(g)的△H=?kJ·mol-1。
CH3OCH3(g)+CO2(g)的△H=?kJ·mol-1。
(2)将合成气以n(H2)/n(CO)=2通入1 L的反应器中,一定条件下发生反应:
4H2(g)+2CO(g)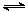 CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
CH3OCH3(g)+H2O(g),其中CO的平衡转化率随温度、压强变化关系如图所示:
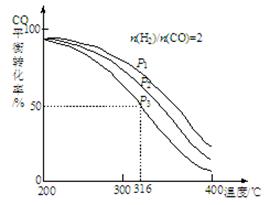
①该反应的平衡常数表达式为?;P1、P2、P3由大到小的顺序为?。
②若反应在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO的转化率?50%(填“大于”、“小于”或“等于”)。
(3)由合成气合成甲醇的反应的温度与平衡常数(K)的关系如表数据,
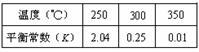
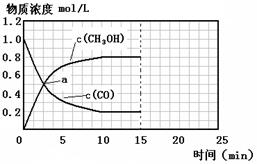
250℃时,将2 molCO和6 molH2充入2L的密闭容器中发生反应,反应时间与物质浓度的关系如图所示,则前10分钟内,氢气的平均反应速率为?;若15分钟时,只改变温度一个条件,假设在20分钟时达到新平衡,氢气的转化率为33.3%,此时温度为?(从上表中选),请在图中画出15—25分钟c (CH3OH)的变化曲线。
(4)利用甲醇液相脱水也可制备二甲醚,原理是:CH3OH +H2SO4→CH3HSO4+H2O,CH3HSO4+CH3OH→CH3OCH3+H2SO4。与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是?。
参考答案:(1)-246.1;
(2)①K=[CH3OCH3][H2O]/ [H2]4[CO]2; P1>P2>P3;②大于;
(3)0.16mol/(L?min);300℃;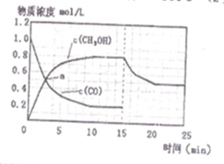 ;
;
(4)硫酸是强酸,具有较强的腐蚀性,能腐蚀设备。
本题解析:(1)①CO(g)+2H2(g) CH3OH(g)? △H1=-90.7 kJ·mol-1
CH3OH(g)? △H1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)? △H2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
CO2(g)+H2(g)? △H3=-41.2 kJ·mol-1
根据盖斯定律,①×2+②+③得3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1;(2)①根据反应4H2(g)+2CO(g)
CH3OCH3(g)+CO2(g)△H=-246.1kJ?mol-1;(2)①根据反应4H2(g)+2CO(g) CH3OCH3(g)+H2O(g)知,该反应的平衡常数表达式K=[CH3OCH3][H2O]/ [H2]4[CO]2;该反应正方向为体积减小的方向,增大压强CO的转化率增大,结合题给图像知,P1>P2>P3;②若在P3和316℃时,起始时起始时n(H2)/n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%;(3)由题给图像知,甲醇的浓度变化为0.8mol/L, V(CH3OH)=△c/△t=0.08mol/(L?min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L?min)=0.16mol/(L?min);改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=3mol/L×33.3%=1mol/L,
CH3OCH3(g)+H2O(g)知,该反应的平衡常数表达式K=[CH3OCH3][H2O]/ [H2]4[CO]2;该反应正方向为体积减小的方向,增大压强CO的转化率增大,结合题给图像知,P1>P2>P3;②若在P3和316℃时,起始时起始时n(H2)/n(CO)=3,则增大了氢气的量,增大氢气的浓度,平衡正移,CO的转化率增大,所以CO转化率大于50%;(3)由题给图像知,甲醇的浓度变化为0.8mol/L, V(CH3OH)=△c/△t=0.08mol/(L?min),根据方程式得V(CH3OH):V(H2)=1:2,所以V(H2)=2×0.08mol/(L?min)=0.16mol/(L?min);改变温度,假设在20分钟时达到新平衡,氢气的转化率为33.3%,则氢气转化的浓度为△C=3mol/L×33.3%=1mol/L,
2H2(g)+CO(g)? CH3OH(g)
起始浓度(1mol/L)? 3? 1? 0
转化浓度(1mol/L)? 1?0.5? 0.5
平衡浓度(1mol/L)? 2?0.5?0.5
K=0.25,所以该温度为300℃;由反应CO(g)+2H2(g)?CH3OH(g)△H1=-90.7kJ?mol-1,该反应为吸热反应,温度升高平衡向移动,甲醇含量减小,图象见答案;(4)该反应有硫酸参加,因为硫酸是强酸,具有较强的腐蚀性,能腐蚀设备。
本题难度:一般
3、选择题 下列图示与对应的叙述相符的是
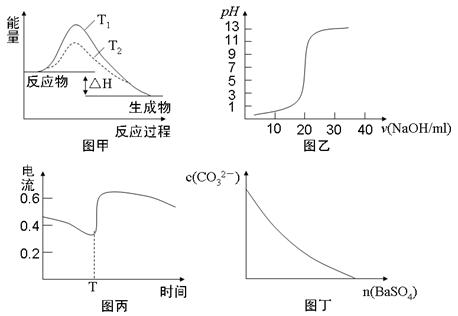
A.图甲表示T1>T2,SO2与O2反应过程中的能量变化
B.图乙表示0.1000mol·L-1NaOH溶液滴定20.00ml0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C.图丙表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2
D.图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化
参考答案:C
本题解析:A、同一反应,温度不同,反应热不同,A错误;B、0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液消耗20ml溶液恰好反应生成醋酸钠,溶液呈碱性,另外曲线的起点,pH应大于1,故B错误;C、H2O2有较强的氧化性,反应更剧烈,电流会变大,C正确;D、在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)先变小,溶解达到平衡状态后,c(CO32-)不会变成0。选C
本题难度:一般
4、填空题 (18分)按要求书写下列热化学方程式
(1)N2(g)和H2(g)反应生成1molNH3(g)放出46.1KJ热量
?
(2)航天领域使用氢氧燃烧电池有酸式和碱式两种,它们放电时的总反应可以表示为2H2 + O2 =2H2O,酸式氢氧燃烧电池的电解池是酸。其负极反应可以表示为2H2-4e-=4H+,则其正极反应可以表示为;?;碱式氢氧燃烧电池的电解质是碱,其正极反应可以表示为:O2+2H2O+4e-=4OH-,则其负极反应可以表示为:?。
(3)用石墨作电极电解NaCl水溶液
阳极的电极反应?,阴极的电极反应?
(4)在粗铜精炼的反应中
?当阳极,发生?(填“氧化”或“还原”)反应,
阳极的电极反应?
(5)将H+、Cu2+、SO42-、Cl-五种离子组成电解质按要求进行电解:以碳棒为电极,使电解质质量减少,水量不变进行电解,应采用的电解质是?、?;
参考答案:(1)N2(g)+ 3H2(g)= 2NH3(g)?△H=-92.2kJ.mol-1
(2)O2 + 4H+ +4e- = 2H2O? 2H2 + 4OH- -4e- = 4H2O
(3)2Cl- - 2e- = Cl2? 2H+ + 2e- = H2
(4)粗铜?氧化? Cu-2e- = Cu2+?(5)CuCl2? HCl
本题解析:(1)考查热化学方程式的书写。
(2)溶液显酸性,所以氧气被还原生成的OH-不可能存在,故正极反应式为O2 + 4H+ +4e- = 2H2O。同样在碱性溶液中氢气被氧化生成的氢离子也不可能存在,所以其负极的电极反应式为2H2 + 4OH- -4e- = 4H2O。
(3)用石墨作电极电解NaCl水溶液时,阳极和阴极的放电微粒分别是Cl-和氢离子,其反应式分别为2Cl- - 2e- = Cl2↑ 2H+ + 2e- = H2↑。
(4)在粗铜精炼的反应中,粗铜作阴极,纯铜作阴极,硫酸铜溶液作电解质溶液。
(5)以碳棒为电极,若使电解质质量减少,水量不变进行电解,则电解质只能是CuCl2?或HCl。
本题难度:简单
5、选择题 已知25℃、101kPa条件下:
4Al (s) + 3O2 (g)=2Al2O3 (s)?△H=-2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s)?△H= -3119.91kJ/mol
由此得出的结论正确的是
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量低,由O2变O3 为吸热反应
C.3O2(g)=2O3 (g)△H=285.0 kJ/mol
D.O3比O2稳定,由O2变O3 为吸热反应
参考答案:BC
本题解析:4Al (s)+3O2(g)═2Al2O3(s)△H=-2834.9kJ?mol-1?①
4Al (s)+2O3(g)═2Al2O3(s)△H=-3119.91kJ?mol-1?②
①-②得3O2(g)═2O3?△H=+285.01kJ?mol-1该反应吸热,等质量的O2比O3能量低,所以O2比O3稳定,由O2变O3为吸热反应,故选:BC。
本题难度:一般