| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《离子方程式的书写及正误判断》高频试题预测(2017年最新版)(四)
参考答案:A 本题解析:A、氧化镁溶于盐酸,没有颜色变化,所以选A;B、氢氧化铜溶于硫酸生成硫酸铜溶液,显蓝色,所以不选B;C、氯化铁和铜反应生成氯化亚铁和氯化铜,溶液的颜色由黄色变成蓝绿色,所以不选C;D、氯化铁与硫氰化钾反应生成红色溶液,所以不选D。 本题难度:一般 2、选择题 下列表示对应化学反应的离子方程式正确的是 |
参考答案:D
本题解析:A、向氯化铝溶液通入过量的氨气,氢氧化铝不溶于弱碱氨水,应生成氢氧化铝沉淀,错误;B、过量氯气通人溴化亚铁溶液中应为3Cl2 +2Fe2+ +4Br- 6Cl-+2Fe3++ 2Br2,错误;C.次氯酸钠与浓盐酸反应产生Cl2应为:ClO-+Cl—+2H+=Cl2↑+H2O,错误;D、NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32—+2H2O,正确。
6Cl-+2Fe3++ 2Br2,错误;C.次氯酸钠与浓盐酸反应产生Cl2应为:ClO-+Cl—+2H+=Cl2↑+H2O,错误;D、NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32—+2H2O,正确。
考点:考查离子方程式正误判断。
本题难度:一般
3、填空题 (6分) 酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4 )去除Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
参考答案: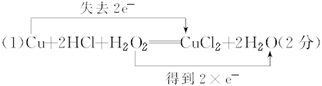
(2)0.032 (3)2Fe3++SO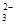 +H2O=2Fe2++SO
+H2O=2Fe2++SO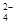 +2H+
+2H+
本题解析:(1)过氧化氢与Cu在酸性条件下发生氧化还原反应,生成氯化铜和水,其中过氧化氢作氧化剂,得到2个电子,Cu作还原剂,失去2个电子,用双线桥表示为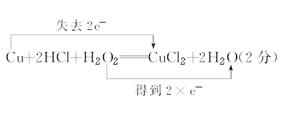 ;
;
(2)300 mL 0.2 mol/L的KI溶液中碘元素的物质的量是0.06mol,与高锰酸钾反应后生成等物质的量的碘和碘酸钾,所以单质碘的物质的量是0.02mol,碘酸钾中碘元素的化合价是+5价,则KI共失去电子的物质的量是0.02mol×2+0.02mol×6=0.16mol,而高锰酸钾被还原为+2价的锰离子,根据得失电子守恒,消耗高锰酸钾的物质的量是0.16mol/5=0.032mol;
(3)Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,说明铁离子与亚硫酸根离子发生氧化还原反应,生成亚铁离子的缘故,离子方程式为2Fe3++SO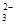 +H2O=2Fe2++SO
+H2O=2Fe2++SO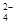 +2H+
+2H+
考点:考查氧化还原反应的分析与计算,双线桥的表示,离子方程式的书写
本题难度:一般
4、选择题 下列反应的离子方程式书写正确的是
A.氯化亚铁溶液中通入氯气:2Fe2+ + Cl22Fe3+ + 2Cl-
B.碳酸钙溶于醋酸:CaCO3 + 2H+Ca2+ + CO2↑ + H2O
C.氯化铝溶液中加入过量氨水:Al3+ + 4NH3?H2O AlO2- + 4NH4+ + 2H2O
D.澄清石灰水与少量小苏打溶液混合:Ca2+ + OH- + HCO3-CaCO3↓+ H2O
参考答案:AD
本题解析:A选项正确,B选项中醋酸为弱电解质,不能拆;C选项中氢氧化铝不能溶于氨水,所以生成的不是偏铝酸根,而是氢氧化铝沉淀。D选项正确。
考点:离子方程式的书写
点评:本题属于常规考题,离子方程式的书写关键在于能拆和不能拆的物质要区分开,电荷守恒,元素守恒,是否符合客观规律,是否有遗漏的离子反应。
本题难度:简单
5、实验题 (10分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
参考答案:Ⅰ、(1) 容量瓶 (2) 2 5 6 2 8 5 O2↑
(3)酸式; 滴入一滴高锰酸钾溶液,溶液呈浅紫色,且30秒内不褪色 (4)17cV/200ρ
本题解析:Ⅰ、(1)容量瓶是一种定容仪器,可以准确量取250mL的液体,故答案为:容量瓶;
(2)双氧水遇到强氧化剂高锰酸钾时表现强的还原性,被氧化为氧气。反应中氧元素的化合价从-1价升高到0价,失去1个电子。Mn元素的化合价从+7价降低到+2价得到5个电子,所以根据电子得失守恒可知配平后的反应方程式为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2 ;
(3)高锰酸钾溶液具有强氧化性,能腐蚀橡胶,所以要放在酸式滴定管中;高锰酸钾本身是一种紫红色的液体,高锰酸钾标准溶液注入滴定管中滴定双氧水时,当达到滴定终点时,溶液呈紫红色,且30秒内不褪,故答案为:酸式;滴入最后一滴高锰酸钾溶液,溶液呈紫红色,且30秒内不褪色;
(4)根据高锰酸钾和双氧水反应的方程式,设双氧水的物质的量为n,则
2MnO4-+6H++5H2O2=2Mn2++8H2O+5O2
2 5
cV×10-3mol n
解得n=2.5cV×10-3mol
所以25.00mL双氧水的质量=2.5cV×10-3mol×34g/mol=0.085cVg,250.00mL双氧水的质量=0.85cVg,则双氧水的质量分数为: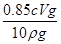 ×100%=
×100%=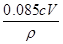 。
。
考点:考查双氧水含量测定的实验设计与探究
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《烷烃》高频.. | |