微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某河道两旁有甲、乙两个化工厂。它们排放的澄清工业废水中共含有Na+、Ag+、Fe3+、C1-、OH-、NO3- 六种离子。
(1)经测定甲厂的废水明显呈酸性,故乙厂废水中所含的三种离子应该是______________。
(2)如果要回收废水中的金属银,可以在废水中加入过量的一种常见金属,反应后的溶液中只含一种金属阳离子,过滤所得固体的成分是_______________,要进一步分离出银,方法是_________________。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,写出生成红褐色沉淀的离子方程式是:_________________________________。
参考答案:(1) OH-、Na+、Cl-
(2)Fe、Ag;向固体中加入足量稀硫酸,充分反应后过滤,洗涤即得到银。
(3) Fe3++3OH-=Fe(OH)3↓
本题解析:
本题难度:一般
2、填空题 离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有______(填编号).
①单质?②氧化物?③电解质?④盐?⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)有一瓶澄清的溶液,其中可能含有H+、NH+4、Mg2+、Ba2+、Al3+、I-、NO-3、CO2-3、SO2-4、AlO-2,取该溶液进行以下实验:
①取pH试纸检验,表明溶液呈强酸性.排除______离子存在.
②取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4呈紫红色,可以排除______存在.
③另取部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在反应过程中均无沉淀产生,则可排除______的存在.
④取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,证明______存在,又排除______存在.
⑤根据上述实验事实还不能确定是否存在的离子是______.
参考答案:(1)离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,故答案为③⑤;
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应,其关系如图所示:
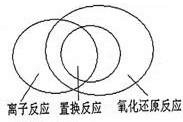
,故答案为:

;
(3)①强酸性溶液中,CO32-、AlO2-能和氢离子反应,不能存在,故答案为:CO32-、AlO2-;
②碘单质在四氯化碳中显示紫红色,说明氯气将碘从溶液中置换出来,一定存在碘离子,在酸性环境下,硝酸根有强氧化性,一定不存在,故答案为:NO3-;
③Mg2+、Al3+和强碱反应过程会产生白色沉淀,所以Mg2+、Al3+不能存在,故答案为:Mg2+、Al3+;
④碳酸根能和钡离子反应生成碳酸钡白色沉淀,证明钡离子一定存在,而钡离子和硫酸根不共存,所以硫酸根一定不存在,故答案为:Ba2+;SO42-;
⑤不确定的离子是铵根离子,故答案为:NH4+.
本题解析:
本题难度:一般
3、选择题 已知向某溶液中逐滴加入NaOH溶液时,测得生成沉淀的质量随所加入NaOH的体积变化如图所示,则该溶液中大量含有的离子可能是
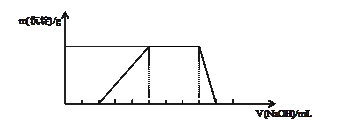
A.H+、NH4+、Al3+、NO3-
B.H+、Al3+、AlO2-、SO42-
C.H+、NH4+、Mg2+、Cl-
D.NH4+、Al3+、Cl-、SO42-
参考答案:A
本题解析:根据图像可知,开始不产生沉淀,说明溶液中含有氢离子,当沉淀最大时,继续加入氢氧化钠,沉淀不变化,但最终沉淀消失。且生成沉淀和溶解沉淀消耗的氢氧化钠是3︰1的,所以一定含有铝离子;所以选项A正确,CD不正确,B中离子不能大量共存,答案选A。
本题难度:一般
4、选择题 在100mL0.10mol·L-1的AgNO3溶液中加入100mL溶有0.01molBaCl2的溶液,再加入100mL溶有0.010mol
CuSO4·5H2O的溶液,充分反应。下列说法中正确的是
[? ]
A.最终得到的白色沉淀是等物质的量的两种化合物的混合物
B.最终得到白色沉淀和无色溶液
C.在最终得到的溶液中,Cl-的物质的量为0.02mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol·L-1
参考答案:A
本题解析:
本题难度:一般
5、选择题 在下列各溶液中,离子一定能大量共存的是
A.pH=7的溶液:Na+、Fe3+、Cl-、SO42-
B.c(H+)=1×10-2mol?L-1的溶液:Na+、NH4+、CO32-、SO42-
C.含有大量SO42-的溶液:K+、Cu2+、Cl-、NO3-
D.含有大量ClO-的溶液:H+、Mg2+、I-、SO42-
参考答案:C
本题解析:分析:A.pH=3.7时Fe3+完全转化为沉淀;
B.c(H+)=1×10-2mol?L-1的溶液显酸性;
C.该组离子之间不反应;
D.利用氧化还原反应来分析.
解答:A.pH=3.7时Fe3+完全转化为沉淀,则pH=7的溶液中不会大量存在Fe3+,故A错误;
B.c(H+)=1×10-2mol?L-1的溶液显酸性,与CO32-结合生成水和气体,在不能共存,故B错误;
C.含有大量SO42-的溶液中该组离子之间不反应,则能够共存,故C正确;
D.因ClO-、H+、I-发生氧化还原反应,则离子不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确信息及离子之间的反应是解答本题的关键,D为学生解答的难点,题目难度不大.
本题难度:简单