| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《化学基本概念》高频考点预测(2017年最新版)(四)
参考答案:B 本题解析:Fe2+中Fe为+2价,处于中间价,Fe2+既有氧化性又有还原性;Fe3+中Fe处于最高价,Fe3+只有氧化性;CO中C为+2价,处于中间价,既有氧化性又有还原性;Cu中Cu为0价,处于最低价,Cu只有还原性。 本题难度:简单 2、选择题 浓硝酸与下列物质反应,其中硝酸既表现酸性又表现氧化性的是 |
参考答案:
本题解析:
本题难度:一般
3、填空题 某研究小组以CaCl2和H2为原料,试图制备 +1价Ca的化合物,结果发现产物中只有两种化合物(甲和乙)。元素组成分析表明化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%;化合物乙的水溶液显酸性。请回答下列问题:
(1)该研究小组是否成功制得 +1价Ca的化合物? (填“是”或“否”)。甲的化学式是 。
(2)甲与水反应可得H2,其化学方程式是 。反应所得溶液经结晶后,可得到一种晶体,其化学式为CaCl2· xCa(OH)2· 12H2O。为确定x的值,请设计实验方案 。
(3)在加热条件下,乙的水溶液(浓)与MnO2反应的离子方程式是 ;乙的水溶液与Fe反应所得的溶液不稳定,保存该溶液的措施是 。
(4)请写出一个你认为可能得到CaCl的化学方程式(以CaCl2为原料) 。
参考答案:(1)否 (1分)CaHCl (2分)
(2)2CaHCl + 2H2O = CaCl2 + Ca(OH)2 + 2H2↑(2分)
取样,加稀HNO3溶解后分成二等份,其中一份加入Na2CO3溶液,得到CaCO3沉淀,称重后求得n(Ca2+);另一份加入AgNO3溶液,得到AgCl沉淀,称重后求得n(Cl-), 用下式即可求得x值: (3分,其它合理答案也给分)
(3分,其它合理答案也给分)
(3)2Cl- + MnO2 + 4H+= Mn2+ + Cl2↑+ 2H2O (2分)
保持FeCl2溶液呈酸性,并加入铁粉防止氧化 (2分)
(4)Ca + CaCl2 = 2CaCl
本题解析:(1)化合物甲中钙、氯元素的质量分数分别为52.36%、46.33%,加起来比100%小,表明该物质中还含有氢元素,其质量分数为:100%-52.36%-46.33%=1.31%。因此,可以来确定甲这种物质的化学式:
N(Ca)
本题难度:一般
4、选择题 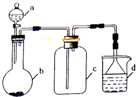 实验室中某些气体的制取 、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
实验室中某些气体的制取 、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:根据装置图可知所制备的气体应为固体和液体制备,并用向上排空气法收集以及采用防倒吸的方法进行尾气处理,根据各选项中反应物的状态判断发生装置、气体的性质以及气体要采用防倒吸解答本题.
解答:A、氨气的密度比空气小,不能使用向上排空气法,故A错误;
B、SO2气体的密度比空气大,能使用向上排空气法,SO2气体能与氢氧化钠迅速反应,所以吸收时要防倒吸,故B正确;
C、铜与稀硝酸反应需要加热,且产生的气体为NO,不能用水吸收,故C错误;
D、制取氯气需要加热,氯气的密度比空气大,能使用向上排空气法,氯气用氢氧化钠溶液吸收时不需要防倒吸,故D错误;
故选B.
点评:本题考查化学实验基本原理(气体的制备),实验装置、仪器的使用,难度不大,掌握物质的性质即可解答.
本题难度:一般
5、选择题 下列说法正确的是
A.根据反应5Fe2++MnO4ˉ+8H+=5Fe3++Mn2++4H2O可知:用酸性KMnO4溶液可检验绿矾(FeSO4·7H2O)是否变质
B.根据反应3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O可知:反应中HNO3表现酸性和氧化性
C.根据反应CuSO4+H2S=CuS↓+H2SO4可知:H2S的酸性比H2SO4强
D.根据反应H3PO3+2NaOH(足量)=Na2HPO3+2H2O可知:H3PO3属于三元酸
参考答案:B
本题解析:酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,A不正确。B中有硝酸铁和NO生成,所以反应中HNO3表现酸性和氧化性,B正确。C不正确,硫化铜不溶于水,也不溶于酸,所以能够发生,但H2S的酸性比H2SO4弱。D不正确,反应中只消耗2mol氢氧化钠,应该是二元酸,答案选B。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《电解质和非.. | |