微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 关于硝酸的说法正确的是
A.Cu可以溶解在稀硝酸中并生成H2
B.浓HNO3不能与非金属单质反应
C.硝酸与金属反应时,主要是+5价的氮元素得电子
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
参考答案:C
本题解析:略
本题难度:简单
2、填空题 (11) 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
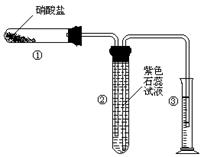
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式:?、?。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式:?;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3 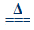 2Ag2O+4NO2↑+O2↑?(Ⅱ)2AgNO3
2Ag2O+4NO2↑+O2↑?(Ⅱ)2AgNO3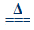 2Ag+2NO2↑+O2↑。
2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是?,并说明理由:?。
请你设计一个简单的实验证明你的结论是正确的:?。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律:?。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
参考答案:(1)Ca(NO3)2受热分解的产物:Ca(NO2)2、O2
(2)Cu(NO3)2受热分解的化学方程式: 2Cu(NO3)2△2CuO+4NO2↑+O2↑
(3) Ⅱ正确;气泡仅部分消失,且剩余氧气等;取少量分解后固体,加入硝酸或氨水;?
(4)硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。?(5)85b/28a%
本题解析:(1)根据题意可得Ca(NO3)2分解的化学方程式:Ca(NO3)2△ Ca(NO3)2+O2 ↑,所以分解产物是Ca(NO3)2和O2;(2)根据题意可得Cu(NO3)2分解的化学方程式:2Cu(NO3)2△2CuO+4NO2↑+O2↑;(3)若是发生Ⅰ反应,由于4NO2+O2+2H2O=4HNO3,液体不会被压至装置③中。若是发生Ⅱ反应,由于产生的NO2和O2的体积比为2:1,所以氧气过量,因此还有不能转换的气体剩余,装置②中气泡部分消失,剩余的气体也能使带火星的木条复燃。溶液也变为红色,现象吻合。因此Ⅱ正确。证明结论的实验是取少量分解后固体,加入硝酸或氨水;观察现象进行分析得到结论。(4)硝酸盐受热分解的规律:硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关。特别活泼的金属的硝酸盐负极得到亚硝酸盐和氧气;比较活泼的金属的硝酸盐分解得到金属氧化物、二氧化氮和氧气,比活泼的金属的硝酸盐分解得到金属单质、二氧化氮和氧气。(5)2AgNO3 △2Ag+2NO2↑+O2↑,2NO2+1/2O2+H2O=2HNO3,反应中的物质的量的关系是2AgNO3~2NO2~1/2O2。若分解2×170g AgNO3,会有1/2×11200ml的水进入量筒,现在有bml的水,所以分解的AgNO3质量是m=2×170b÷11200g.而加入的AgNO3质量是ag,所以硝酸银的分解率是(m÷a)×100%=(2×170b÷11200g)÷a×100%=85b/28a%
本题难度:一般
3、选择题 若2 mol Mg跟5 mol HNO3恰好完全反应,则在该反应中的稀硝酸被还原成为
A.NO2
B.NO
C.N2O
D.N2
参考答案:C
本题解析:略
本题难度:简单
4、选择题 2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法错误的是
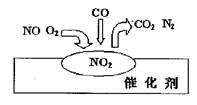
A.汽车尾气的主要污染成分包括CO和NO
B.NO2是该过程的中间产物
C.NO和O2必须在催化剂表面才能反应
D.该催化转化的总反应方程式为:2NO+O2+4CO 4CO2+N2
4CO2+N2
参考答案:C
本题解析:略
本题难度:一般
5、选择题 铜和镁的合金4.7克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已经折算成标准状况)。在反应后的溶液中加入足量的NaOH溶液,生成沉淀的质量为
A.9.02g
B.8.26g
C.8.61g
D.7.04g
参考答案:C
本题解析:根据题意最终生成的沉淀是氢氧化铜和氢氧化镁,由于金属失去电子的物质的量就是金属阳离子结合的OH-的物质的量。NO2和N2O4分别是0.2mol和0.015mol,所以反应中转移电子是0.2mol+0.015mol×2=0.23mol,则结合的OH-的质量是0.23mol×17g/mol=3.91g,所以沉淀的质量是3.91g+4.7g=8.61g,答案选C。
本题难度:一般