微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为测定某补血剂样品〔主要成分是硫酸亚铁晶体(FeSO4·7H2O)〕中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
⑴写出滴定反应的离子方程式?。
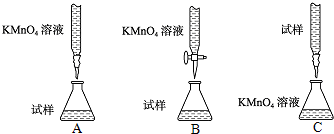
(2)下列滴定方式中,最合理的是??(夹持仪器略去)(填字母序号〕
(3)实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_?(填仪器名称)。
(4)若某同学取5片补血剂样品配成100 mL溶液,取20. 00 mL试样,用浓度为c1mol·L-1的KMnO4溶液滴定,耗去V1 mL,则每片补血剂含铁元素的质量_?g(用代数式表示)。
方案二:将FeSO4转化为Fe2O3,测定质量变化。操作流程如下:
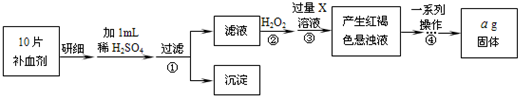
(5)步骤②中用H2O2的目的是_?_。
(6)步骤④中一系列操作依次是:过滤、洗涤、_?、冷却、称量。
(7)假设实验无损耗,则每片补血剂含铁元素的质量为_?g(用含a的代数式表示)。
(8)若某同学设计以原电池的形式实现Fe2+至Fe3+的转化,正极通人O2,电解质溶液为稀硫酸,请写出正极的电极反应式?。
参考答案:(15分(1)5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O (2分) (2)B (1分)
(3)50mL容量瓶(2分,不答规格得0分) (4)0.28c1v1(2分)
(5)将Fe2+氧化成Fe3+(2分) (6)灼烧 (1分)?(7)0.07a (2分)
(8)O2+4e-+4H+=2H2O(2分)
本题解析:(1)酸性高锰酸钾具有强氧化性,将Fe2+氧化为Fe3+,MnO4-被还原为Mn2+,同时生成水,反应离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(2)酸性高锰酸钾具有强氧化性,可以腐蚀橡皮管,应盛放在酸式滴定管内,硫酸亚铁溶液呈酸性,应盛放在酸式滴定管内,装置A和C中均是碱式滴定管,所以B最合适。
(3)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、250mL容量瓶,远程还缺少250mL容量瓶。
(4)消耗高锰酸钾得物质的量是0.001c1v1mol,根据方程式可知,亚铁离子的物质的量是0.005c1v1mol,则5片补血剂样品中亚铁离子的物质的量是0.005c1v1mol× =0.025c1v1mol,所以每片补血剂样品中亚铁离子的物质的量是0.005c1v1mol,因此每片补血剂含铁元素的质量是0.005c1v1mol×56g/mol=0.28c1v1g。
=0.025c1v1mol,所以每片补血剂样品中亚铁离子的物质的量是0.005c1v1mol,因此每片补血剂含铁元素的质量是0.005c1v1mol×56g/mol=0.28c1v1g。
(5)要将亚铁离子氧化生成铁离子,则需要加入氧化剂。双氧水是常用的绿色氧化剂,因此双氧水的作用是将Fe2+氧化成Fe3+。
(6)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成的氧化铁,冷却后称量氧化铁的质量。
(7)根据铁原子守恒可知,ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量为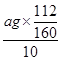 =0.07ag;
=0.07ag;
(8)原电池中正极得到电子,发生还原反应。氧气在正极通入,且溶液显酸性,所以正极电极反应式为O2+4e-+4H+=2H2O。
本题难度:一般
2、计算题 10gFe-Mg合金溶解在一定量的某浓度的稀硝酸中,当金属完全反应后,收集到标况下4.48LNO气体(设还原产物只有NO,铁只生成Fe2+)。
(1)反应中被还原的硝酸物质的量是多少
(2)在反应后的溶液中加入足量的NaOH溶液,可得多少克沉淀?
参考答案:(3 分)(1)0.2mol?(5分)
分)(1)0.2mol?(5分)
(2)因为Mg,Fe失电子数等于氮元素得电子数。
n失=n得=4.48L÷22.4L.mol-1×3=0.6mol?Fe,Mg失电子后的阳离子所带正电荷共为0.6mol,它也等于沉淀该阳离子所需OH-的物质的量。即n(OH-)=0.6mol。m沉淀=m阳+m(OH-)=10g+0.6mol×17g.mol-1=20 .2g
.2g
本题解析:略
本题难度:一般
3、填空题 (10分)向硫酸亚铁溶液中滴加氢氧化钠溶液,实验的现象是:有?色沉淀产生,迅速变为?色,?最后变为?色。有关的化学方程式为:
1)?2)?
参考答案:白?灰绿?红褐
1)FeSO4 + 2NaOH ="=" Fe(OH)2↓ + Na2SO4
2)4Fe(OH)2 + O2 + 2H2O ="=" 4Fe(OH)3
本题解析:考查Fe(OH)2的制取及性质
制取:FeSO4 + 2NaOH ="=" Fe(OH)2↓ + Na2SO4
Fe(OH)2易被氧化,颜色由白色迅速转化为灰绿色,最终为红褐色的Fe(OH)3:4Fe(OH)2 + O2 + 2H2O ="=" 4Fe(OH)3
本题难度:一般
4、选择题 ag铁粉与含有H2SO4的CuSO4溶液完全反应后,固体质量与反应前相同, 则
参加反应的CuSO4与H2SO4的物质的量之比为
A.1 :7
B.7 :1
C.7 :8
D.8 :7
参考答案:B
本题解析:设铁的物质的量是x,消耗的硫酸的物质的量是y,
Fe先与CuSO4反应,再与H2SO4反应,
因为a/56 > a/64,所以CuSO4反应完全, 剩余Fe与H2SO4反应,
则由定量关系得:
Fe----Cu
x? (a/64)mol
则x=(a/64)mol
Fe-------------------H2SO4
(a/56-a/64)mol?y
则y=(a/56-a/64)mol
所以
n(CuSO4):n(H2SO4)=x:y=(a/64):(a/56-a/64) =7:1。
故选B。
点评:此题要特别注意过量和不足的问题,计算之前就要根据条件作出判断。
本题难度:简单
5、计算题 (6分)现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
加硫酸的序号
| 加入硫酸的体积/mL
| 剩余固体的质量/g
|
1
| 20.0
| 7.20
|
2
| 20.0
| 4.40
|
3
| 20.0
| 2.00
|
4
| 20.0
| 2.00
|
试计算:
(1)此样品中铁的质量分数。
(2)所用硫酸溶液溶质的物质的量浓度。
参考答案:(1)80%?(2)2.5mol/L
本题解析:(1)根据表中数据可知,最后剩余铜2 g,则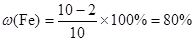
(2) Fe? +? H2SO4? =" Fe" SO4 + H2↑
56g? 1mol
2.8g?c(H2SO4)×0.02L
所用硫酸溶液溶质的物质的量浓度c (H2SO4)=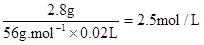
点评:本题主要考查学生的分析能力,很简单基础。
本题难度:一般