微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图所示,分馏装置中,如果有错误请指出并加以改正:
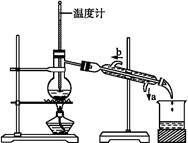
(1) _____________________________,?
(2) _____________________________,?
(3) _____________________________。?
参考答案:(1)蒸馏烧瓶中温度计水银球应在支管口处,而不应插在液面下
(2)冷凝管的冷水流向是错误的,应从a处流入b处流出
(3)接收仪器应用小口的锥形瓶,而不应用大口的烧杯,以免蒸气挥发太多
本题解析:本题主要考查有关蒸馏操作方面的知识。(1)温度计测量的是蒸气的温度,所以应该放在支管口处;(2)冷凝水的流向和蒸气的流向恰好相反,冷却效果好;(3)收集装置应该用锥形瓶,减少蒸气挥发。
本题难度:一般
2、选择题 在标准状况下,1.6L氮气中含m个分子,则阿伏加德罗常数为
A.14m
B.28m
C.
D.7m
参考答案:A
本题解析:分析:根据n=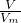 =
=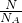 计算.
计算.
解答:n(N2)=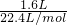 =
=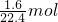 ,
,
则NA=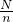 =
= =14m,
=14m,
故选A.
点评:本题考查阿伏加德罗常数的计算,题目难度不大,注意有关计算公式的运用.
本题难度:困难
3、实验题 芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸。反应原理:
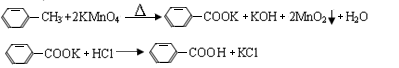
反应试剂、产物的物理常数:
名称
| 相对分子质量
| 性状
| 熔点
| 沸点
| 密度
| 溶解度
|
水
| 乙醇
| 乙醚
|
甲苯
| 92
| 无色液体易燃易挥发
| -95
| 110.6
| 0.8669
| 不溶
| ∞
| ∞
|
苯甲酸
| 122
| 白色片状或针状晶体
| 122.4
| 248
| 1.2659
| 微溶
| 易溶
| 易溶
|
主要实验装置和流程如下:

图1回流搅拌装置?图2抽滤装置?
实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
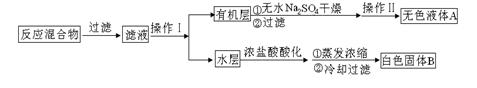
(1)仪器K的名称为?。无色液体A的结构简式为?。操作Ⅱ为?。
如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是?。
(3)下列关于仪器的组装或者使用正确的是?。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触
C.抽滤结束后,为防止倒吸,应先关闭水龙头,再断开真空系统与过滤系统的连接
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入?,分液,水层再加入?,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为?。
参考答案:(1)安全瓶(1分) (2分)?蒸馏(2分)?
(2分)?蒸馏(2分)?
(2)除去未反应的高锰酸钾氧化剂,否则用盐酸酸化时会发生盐酸被高锰酸钾所氧化,产生氯气;(2分)
(3)ABD (2分)漏选得一分,错选不得分
(4) NaOH溶液(2分)?浓盐酸酸化(2分)
(5)? 96% (2分
本题解析:
(1)仪器K为减压过滤(抽滤)装置中的安全瓶;
由实验流程可知,反应混合物首先经过过滤除去用高锰酸钾氧化甲苯后生成的MnO2
沉淀,过滤后的滤液经分液得到含有末反应的甲苯的有机层和含有苯甲酸钾等可溶性物质的水层。然后,将有机层经干燥剂干燥、过滤,再经蒸馏回收得到甲苯,所以无色液体A
为甲苯( )。根据反应原理,可知水层中的
)。根据反应原理,可知水层中的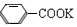 经浓盐酸酸化,转化为苯甲酸,因苯甲酸微溶于水,再经蒸发浓缩,冷却结晶,就可得到白色的苯甲酸晶体(无色固体B)。
经浓盐酸酸化,转化为苯甲酸,因苯甲酸微溶于水,再经蒸发浓缩,冷却结晶,就可得到白色的苯甲酸晶体(无色固体B)。
(2) 滤液呈紫色,说明滤液中含有末反应的高锰酸钾,亚硫酸氢钾是一种还原剂,先加亚
硫酸氢钾,是使其与高锰酸钾反应,除去末反应的高锰酸钾,否则当用浓盐酸酸化时,高
锰酸钾就会与浓盐酸反应产生氯气。
(3) 抽滤可以加快过滤速度,得到较干燥的沉淀;安装电动搅拌器时,搅拌棒下端不能与三颈烧瓶底、温度计等接触;抽滤结束后,为防止倒吸,应先断开真空系统与过滤系统的连接,再关闭水龙头;冷凝管中水的流向应是下进上出。C不正确,A、B、D正确。
(4) 甲苯不溶于水,要除去残留在苯甲酸中的甲苯时,先加入NaOH溶液,使其与苯甲酸反应,将苯甲酸转化为可溶性的苯甲酸钠,再经分液操作,将甲苯(有机层)除去,然后再用浓盐酸酸化,把可溶性的苯甲酸钠转化为苯甲酸。
(5) 根据反应: 
122g? 1mol
m? 2.4×10-3mol
m="122g/mol" ×2.4×10-3mol = 1.1712g;
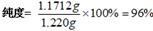
本题难度:一般
4、选择题 通过加入适量的化学药品,采用恰当的分离提纯方法,除去某溶液里溶解的杂质,下列做法中不正确的是(括号内的物质为杂质)
A
| NaCl溶液(BaCl2)
| 加Na2CO3溶液,过滤,再加适量盐酸
|
B
| KNO3溶液(AgNO3)
| 加适量KCl溶液,过滤
|
C
| NaCl溶液(I2)
| 加酒精,分液
|
D
| KNO3溶液(I2)
| 加CCl4,分液
参考答案:C
本题解析:略
本题难度:一般
5、选择题 标准状况下V L的HCl气体溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是
A.c=1000Vρ/(36.5V+22400)
B.ω=36.5V/(36.5V+22400)
C.ω=36.5c/(1000ρ)
D.ρ=(36.5V+22400)/(22.4+22.4V)
参考答案:D
本题解析:试题分析:A、标准状况下VLHCl溶解在1L水中,所得溶液的质量为 [(V/22.4)×36.5+1000]g,因此所得溶液的体积为{[(V/22.4)×36.5+1000]/ ρ}mL="{[(V/22.4)×36.5+1000]/1000" ρ}L,所得溶液中溶质的物质的量="(V/22.4)" mol,则所得溶液的物质浓度为(V/22.4)/{[ (V/22.4) ×36.5+1000]/ 1000ρ}=1000Vρ/(36.5V+22400);故A正确;
B、标准状况下VLHCl溶解在1L水中,所得溶液中溶质质量为(V/22.4)×36.5 g,则所得溶液的质量分数为ω="[(V/22.4)×36.5]/[" [(V/22.4) ×36.5+1L×1000×1g/mL] =36.5V/(36.5V+22400);故B正确;
C、标准状况下VLHCl溶解在1L水中,所得溶液的体积为1L,所得溶液中溶质质量="1L×c" mol/L×36.5g/mol="36.5c" g,所得溶液的质量="1L×1000×ρ" g/mL="1000ρ" g,则所得溶液的溶质质量分数=36.5c/1000ρ;故C正确;
D、标准状况下VLHCl溶解在1L水中,所得溶液的质量为(V/22.4)×36.5+1L×1000×1g/mL=[(V/22.4)×36.5+1000]g,所得溶液的体积为1L=1000mL,则所得溶液的密度ρ="[" (V/22.4) ×36.5+1000]/1000=(36.5V+22400)/22400;故D不正确;故选D。
考点:有关溶质质量分数的简单计算
点评:标准状况下,每1mol的气体的体积为22.4L,利用这一关系由气体体积求得气体的物质的量、物质的质量,此为本问题分析中所需使用的关系。
本题难度:一般
|