|
高考化学试题《离子共存》试题巩固(2017年最新版)(六)
2017-08-08 06:17:08
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3-
B.加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3-
C.含有大量ClO-的溶液中:K+、Na+、NO3-、SO42-
D.0.1mol/LFeCl3溶液中:Na+、NH4+、SCN-、SO42-
|
参考答案:C
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。则A、0.1 mol·L-1NaAlO2溶液中Al3+与偏铝酸根离子水解相互促进生成氢氧化铝沉淀,不能大量共存,A错误;B、加入金属铝产生H2的溶液可能显酸性,也可能显碱性。显酸性,则硝酸根与金属反应得不到去。显碱性,则NH4+不能大量共存,B错误;C、含有大量ClO-的溶液中:K+、Na+、NO3-、SO42-可以大量共存,C正确;D、0.1mol/LFeCl3溶液中SCN-不能大量共存,D错误,答案选C。
考点:考查离子共存的正误判断
本题难度:一般
2、填空题 离子反应是中学化学中重要的反应类型,回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________(填编号)。
①单质?②氧化物?③电解质?④盐?⑤化合物
(2)一种无色透明溶液中,可能含有下列离子: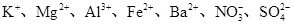 、 、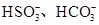 、I-和Cl-,取该溶液进行如下实验: 、I-和Cl-,取该溶液进行如下实验:
①将溶液滴在蓝色石蕊试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体通空气则立即变成红棕色。
③取少许溶液滴入BaCl2溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入AgNO3试液,产生不溶于稀硝酸的白色沉淀。
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是_______;肯定存在的离子是_______;不能作出判断的离子是_______。
参考答案:(1)③⑤? (2)Fe2+、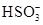 、 、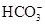 、I-、Ba2+ 、I-、Ba2+
Mg2+、Al3+、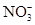 、 、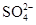 ? K+、Cl- ? K+、Cl-
本题解析:(1)有离子参与或生成的反应是离子反应,只要有离子,就必有电解质,而电解质属于化合物。
(2)由无色溶液知,溶液中一定不存在Fe2+;由实验①知,溶液呈酸性,则Mg2+、Al3+、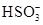 中至少存在一种;由实验②知,溶液中一定存在 中至少存在一种;由实验②知,溶液中一定存在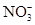 ;由实验③知,溶液中一定存在 ;由实验③知,溶液中一定存在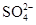 ,则溶液中一定不存在Ba2+;由于实验③中已经引入Cl-,所以由实验④无法确定Cl-的存在;由实验⑤知,产生的白色沉淀部分溶解,则溶液中一定存在Mg2+和Al3+,则溶液中一定不存在 ,则溶液中一定不存在Ba2+;由于实验③中已经引入Cl-,所以由实验④无法确定Cl-的存在;由实验⑤知,产生的白色沉淀部分溶解,则溶液中一定存在Mg2+和Al3+,则溶液中一定不存在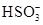 和 和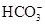 ?(水解相互促进反应);由于溶液呈酸性,且存在 ?(水解相互促进反应);由于溶液呈酸性,且存在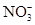 ,所以溶液中一定不存在I-。综合分析:溶液中肯定不存在的离子是:Fe2+、 ,所以溶液中一定不存在I-。综合分析:溶液中肯定不存在的离子是:Fe2+、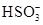 、 、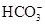 、I-、Ba2+,溶液中肯定存在的离子是:Mg2+、Al3+、 、I-、Ba2+,溶液中肯定存在的离子是:Mg2+、Al3+、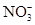 、 、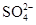 ,溶液中无法确定的离子是:K+、Cl- ,溶液中无法确定的离子是:K+、Cl-
本题难度:一般
3、选择题 水溶液中能大量共存的离子组是
A.Fe3+、Na+、SO42-、Cl-
B.H+、Fe2+、Cl-、NO3-
C.Ag+、Na+、CO32-、NO3-
D.Al3+、K+、Cl-、AlO2-
参考答案:A
本题解析:Fe3+、Na+、SO42-、Cl-之间不能反应,故A正确;亚铁离子、硝酸根离子在酸性条件下发生氧化还原反应,生成铁离子、NO、水,故B错误;银离子与碳酸根离子反应,生成碳酸银沉淀,故C错误;铝离子与偏铝酸根离子在水溶液中发生双水解反应,生成氢氧化铝,故D错误。
本题难度:简单
4、选择题 如果NO3-、Fe2+、SO42-、M四种离子以物质的量之比4∶2∶1∶2共存于同一溶液中,那么,M可能是(?)
A.Cl-
B.Na+
C.H+
D.Mg2+
参考答案:B
本题解析:在酸性条件下,NO3-能把Fe2+氧化生成Fe3+,所以M一定不是氢离子;根据溶液是电中性可知,M是阳离子,且是钠离子,答案选C。
点评:该题是中等难度的试题,试题设计新颖,基础性和灵活性强。有利于考查学生的灵活应变能力,也有利于提高学生分析问题、解决问题的能力。
本题难度:一般
5、选择题 室温时,某溶液中由水电离生成的H+和OH-物质的量浓度的乘积为10-24,则在该溶液中一定不能大量共存的离子组是(?)
A.Al3+、Na+、NO3-、Cl-
B.K+、Na+、Cl-、CO32-
C.K+、Na+、Cl-、SO42-
D.NH4+、K+、SiO32-、NO3-
参考答案:D
本题解析:水电离的H+和水电离的OH-一定相等,所以由水电离生成的H+和OH-物质的量浓度的乘积为10-24的溶液水电离的H+为10-12,则溶液或呈酸性或呈碱性。A项中的Al3+只能在酸性溶液中存在,B项中的CO32-只能在碱性溶液中存在,C项中的所有离子酸性、碱性溶液中都能存在,D项中的离子酸性NH4+只能在酸性溶液中存在,SiO32-只能在碱性溶液中存在。答案选D。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
|