微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在海水中所含的元素,大部分以盐的形式存在,其中,主要是NaCl、MgCl2、MgSO4、CaSO4等,若把海水中的这些盐都提取出来,平铺在地球的陆地上,可以使陆地增高米.
A.200
B.300
C.150
D.250
参考答案:C
本题解析:
本题难度:一般
2、选择题 从海水中提取镁,最基本的方法是往海水里加碱,得到Mg(OH)2沉淀,将沉淀分离出来后再加入盐酸把它变成MgCl2;之后,经过滤、干燥、电解,即可得到金属镁。下列对从海水中提取镁的有关说法中,正确的是
[? ]
A.整个过程中没有涉及置换反应
B.往海水里加碱是指直接加入NaOH
C.电解MgCl2溶液即可得到金属镁
D.电解时得到的镁蒸气应在CO2氛围中冷却
参考答案:A
本题解析:
本题难度:一般
3、填空题 海洋植物如海带、马尾藻等含有丰富的碘元素,实验室从海带中提取碘的流程如下: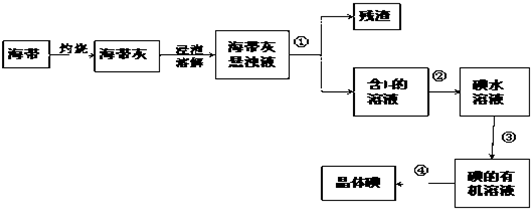
(1)提取碘的过程中有关实验的操作名称①______、②______、③______、④______.
(2)写出过程②中有关反应的离子方程式______;该反应中氧化剂是______,氧化产物是______.
(3)提取碘的过程中,可选择得有机试剂是______;
A.酒精B.水C.四氯化碳D.甘油
在碘水中加入上述有机试剂,振荡静置,可观察到的现象是______.
参考答案:实验室从海带中提取碘:海带灼烧成灰,浸泡溶解得到海带灰悬浊液,通过过滤,得到不溶的残渣,滤液为含碘离子的溶液,加入氧化剂,将碘离子氧化成碘单质,利用有机溶剂萃取出碘单质,再通过蒸馏提取出碘单质.
(1)步骤①是分离固体和液体,则实验操作为过滤;过程②中氯气将碘离子氧化为碘单质;利用碘易溶于有机溶剂的性质来进行提取,步骤③的实验操作名称是萃取分液;步骤④的目的是从含碘苯溶液中分离出单质碘和回收苯,是利用互溶的两种液体的沸点不同来分离,则实验操作为蒸馏,
故答案为:过滤;氧化;萃取分液;蒸馏;
(2)氯气可将碘离子氧化为碘单质,反应的离子方程式为2I-+Cl2=2Cl-+I2,反应中Cl元素化合价降低,被还原,Cl2为氧化剂,Cl-为还原产物,I元素化合价升高,被氧化,I-为还原剂,I2为氧化产物,
故答案为:2I-+Cl2=2Cl-+I2;Cl2;I2;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,酒精、甘油和水互溶,不能用作萃取剂,四氯化碳与水互不相容,故可用四氯化碳;四氯化碳密度比水大,在碘水中加入上述有机试剂,振荡静置,可观察到的现象是:分层,上层颜色变浅,可能为无色,下层为紫红色,
故答案为:C;分层,上层颜色变浅,可能为无色,下层为紫红色.
本题解析:
本题难度:一般
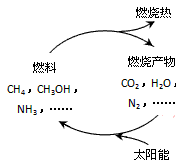
4、填空题 (1)能源是当今社会发展的三大支柱之一。天然气是一种高效、低耗、污染小的清洁能源,主要成分为甲烷,甲烷燃烧的化学方程式为:__________ , 标准状况下,11.2L甲烷燃烧时,转移电子的物质的量为________ __ mol。? 在如下图构想的物质循环中太阳能最终转化为 _________能。
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则负极的电极反应式为________ , 正极的电极反应式为 _________。 【提示:电化学的总反应式为2Fe+2H2O+O2==2Fe(OH)2】

(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:

操作①的名称是_________ ;反应②的离子方程式是__________ ,下述物质中不可做试剂③的是____________ 。
A.乙醇
B.苯
C.乙酸
D.四氯化碳
参考答案:(1)CH4 +2O2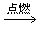 CO2 +2H2O;4; 热。
CO2 +2H2O;4; 热。
(2)2Fe - 4e- == 2Fe2+, O2 + 2H2O + 4e- = 4OH-
(3)溶解、过滤; H2O2 +2I-+2H+ = 2H2O + I2;? AC。
本题解析:
本题难度:一般
5、填空题 海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下图:
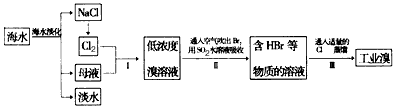
(1)步骤I中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为____________________;
(2)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,反应方程式为__________________;
(3)Br-的检验主要试剂是__________,离子方程式为_______________________;
(4)从工业溴中提纯溴,查阅了有关资料,Br2的颜色为__________ ,沸点为59℃,微溶于水,有毒性和强腐蚀性;
(5)上述工业残留液中有少量Cl2,可向其中加入NaBr溶液,反应的离子方程式为_________________,反应后其分离操作是________。
参考答案:(1)富集溴元素
(2)Br2+SO2+2H2O = H2SO4+2HBr
(3)AgNO3;Ag++Br- = AgBr↓
(4)深红棕色
(5)Cl2+2Br- = Br2+2Cl-;分液(或蒸馏)
本题解析:
本题难度:一般