|
高考化学知识点总结《水的电离平衡》考点特训(2017年冲刺版)(二)
2017-08-08 06:22:37
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是
A.水电离出的H+的浓度是1.0×10-4 mol·L-1
B.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3)
C.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3)
D.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-)
|
参考答案:B
本题解析:NaHSO3溶于水后存在如下过程:
NaHSO3=2Na++HSO3-; HSO3-?H++SO32-; HSO3-+H2O?H2SO3+OH-;由于溶液的pH=4,即NaHSO3在水溶液中以电离为主,水解为次。即分析得:水电离出的H+的浓度是1.0×10-10mol·L-1 A错;在盐溶液中,离子浓度大小的分析为,未电离和未水解的离子为主,B正确;C选项为物料守恒,正确;D为质子守恒,错误;
本题难度:一般
2、选择题 下列化学反应中,离子方程式表示正确的是( )
A.少量金属钠加到冷水中:Na+2H2O═Na++OH-+H2↑
B.铁粉加到盐酸中:Fe+2H+═Fe2++H2↑
C.石灰石溶解在稀HCl中:CO32-+2H+═CO2↑+H2O
D.硫酸溶液与氢氧化钡溶液混合:Ba2++OH-+SO42-+H+═H2O+BaSO4↓
参考答案:B
本题解析:
本题难度:简单
3、填空题 (15分)信息时代产生的大量电子垃圾对环境构成了威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
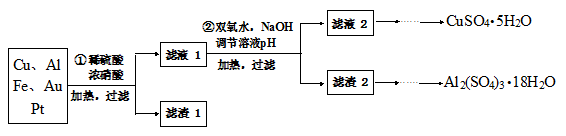
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 。
(3)该探究小组提出两种方案测定CuSO4·5H2O晶体的纯度。
方案一:取ag试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol·L-1Na2S2O3标准溶液滴定(原理为:I2+2S2O32-===2I-+S4O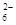 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。 ),到达滴定终点时,消耗Na2S2O3标准溶液20.00mL。
①滴定过程中可选用 作指示剂,滴定终点的现象是 。
②CuSO4溶液与KI反应的离子方程式为 。
方案二:取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液6 mL。滴定反应如:Cu2++H2Y2-=CuY2-+2H+。
③写出计算CuSO4·5H2O质量分数的表达式ω= 。
④下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。(填序号)
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
参考答案:(15分)
(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(2)将Fe2+氧化成Fe3+(2分)
(3)①淀粉溶液(2分) 蓝色刚好褪去,且半分钟内不恢复蓝色(2分)
②2Cu2++4I-=2CuI↓+I2(2分)
③7.5c/a×100%(3分) ④c(2分)
本题解析:(1)Cu与稀硫酸、浓硝酸的混合液反应,生成铜离子、二氧化氮(或NO)、水,离子方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O或3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)从流程图可知,制备硫酸铝和硫酸铜晶体,需除去铁元素,所以加入过氧化氢的目的是将Fe2+氧化成Fe3+,便于除去;
(3)①Na2S2O3标准溶液滴定溶液中的碘单质,所以选择淀粉作指示剂;碘遇淀粉变蓝色,则滴定终点时,溶液由蓝色变为无色,且半分钟内不恢复;
②根据题意可知硫酸铜与KI溶液发生反应,生成白色沉淀,则该白色沉淀是CuI沉淀,根据氧化还原反应规律,则产物中I元素的化合价升高到0价,有碘单质生成碘,离子方程式为2Cu2++4I-=2CuI↓+I2;
③根据所给数据,EDTA~Cu2+,则溶液中Cu2+的物质的量是6×10-3L×cmol/L×100/20=0.03cmol,则CuSO4·5H2O质量分数为0.03cmol×250g/mol/ag×100%=7.5c/a×100%;
④a.未干燥锥形瓶,对实验结果无影响,错误;b.滴定终点时滴定管尖嘴中产生气泡 ,会导致末读数的数值偏小,测定结果偏低,错误; c.未除净可与EDTA反应的干扰离子,导致消耗EDTA偏多,测定结果偏高,正确,答案选c。
考点:考查物质制备流程图的分析,离子方程式的书写,化学反应的判断,实验结果的计算与误差分析
本题难度:困难
4、选择题 下列表述或判断不正确的是
? [? ]
A.根据CH3COO-+ H2O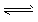 CH2COOH+OH-能说明CH3COOH是弱电解质 CH2COOH+OH-能说明CH3COOH是弱电解质
B.根据NH3+H3O+==NH4+ +H2O能说明NH3结合H+的能力比H2O强
C.pH相等的①Na2CO3;②NaOH;③CH3COONa三种溶液,物质的量浓度的大小顺序为:③>①>②
D.相同条件下等物质的量浓度的①NaCl溶液;②NaOH溶液;③HCl溶液中由水电离出的c(H+):③>①>②
参考答案:D
本题解析:
本题难度:一般
5、选择题 在 溶液中,下列等量关系成立的是( ) 溶液中,下列等量关系成立的是( )
A.c(OH-)= c(H+)+c(HCO3-)+2c(H2CO3)
B.2c(Na+)= c(CO32-)+ c(HCO3-)+ c(H2CO3)
C.c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-)
D.c(Na+)="2" c(CO32-)+ c(HCO3-)+ c(H2CO3)
|  溶液中,根据电荷守恒,可得到c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-),故C正确,根据物料守恒,可得到c(Na+)="2" c(CO32-)+2 c(HCO3-)+ 2c(H2CO3),所以BD错误,将c(Na+)="2" c(CO32-)+2 c(HCO3-)+ 2c(H2CO3)代入c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-),整理可以得到c(H+)+ 2c(H2CO3) + c(HCO3-)= c(OH-),故A也正确,所以答案为AC。
溶液中,根据电荷守恒,可得到c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-),故C正确,根据物料守恒,可得到c(Na+)="2" c(CO32-)+2 c(HCO3-)+ 2c(H2CO3),所以BD错误,将c(Na+)="2" c(CO32-)+2 c(HCO3-)+ 2c(H2CO3)代入c(Na+)+ c(H+)= c(HCO3-) +2c(CO32-)+ c(OH-),整理可以得到c(H+)+ 2c(H2CO3) + c(HCO3-)= c(OH-),故A也正确,所以答案为AC。