微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)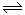 2SO3(g) △H<0,下列研究目的和图示相符的是?
2SO3(g) △H<0,下列研究目的和图示相符的是?
(填序号)
序号
| A
| B
| C
| D
|
目的
| 压强对平衡的影响
| 温度对转化率的影响
| 增加O2浓度对速率的影响
| 浓度对平衡常数的影响
|
图示
| 
| 
| 
| 
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
?乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
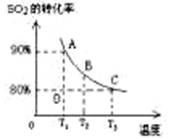
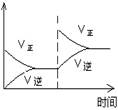
Ⅰ.在T1温度下,反应进行到状态D时,v正?v逆。(填“>”“<”或“="”" )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是?。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为?。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为?。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为? ?。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
2、计算题 恒温下,将amol N2和bmol H2的混合气体通入一固定容积的密闭容器中,发生如下反应:
N2(g)+3H2(g) 2NH3(g),
2NH3(g),
(1)若反应进行到某时刻t时刻,n(N2)=13mol,n(NH3)=6mol,计算a的值
(2)反应达到平衡时,混合气体的体积为716.8L(标况),其中NH3的含量为25%(体积分数),则平衡时n(NH3)=?
(3)原混合气体与平衡时混合气体的总物质的量之比n(始):n(平)=?
(4)原混合气体中,a:b=?
(5)达到平衡时,N2和H2的转化率之比为多少?
(6)平衡混合气体中,n(N2) :n(H2): n(NH3)=?
3、选择题 如图所示为条件一定时,反应2NO(g)+O2(g)?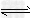 2NO2(g)+Q(正反应为放热)中NO的转化率与温度变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是
2NO2(g)+Q(正反应为放热)中NO的转化率与温度变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是

[? ]
A.a?
B.b
C.c?
D.d
4、填空题 某温度时,在一个2L的密闭容器中,H2、N2、NH3三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题:

(1)图中X曲线代表?(填化学式);
(2)从开始至2min,NH3的平均反应速率是?;
(3)第4分钟时下列叙述正确的是?;
A.该反应已停止
B.单位时间内氮气的消耗速率等于氢气的生成速率
C.3v(H2)=2v(NH3)
D.c(H2) :c(N2) :c(NH3) =" 7" :9 :2