微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 鉴别下列各组物质的水溶液所选的试剂(括号内)中不正确的是( )
A.白酒、食醋(NaHCO3溶液)
B.葡萄糖、福尔马林[新制Cu(OH)2悬浊液]
C.食盐、纯碱(盐酸)
D.淀粉、鸡蛋清(碘水)
参考答案:A、白酒和碳酸氢钠互溶但不反应,无现象,食醋和碳酸氢钠反应生成二氧化碳气体,二者现象不同,可以鉴别,故A正确;
B、葡萄糖和甲醛都含有醛基,都能和新制氢氧化铜悬浊液反应生成砖红色沉淀,二者现象相同,不能鉴别,故B错误;
C、食盐和盐酸不反应,碳酸钠和盐酸反应生成二氧化碳气体,二者现象不同,可鉴别,故C正确;
D、淀粉遇碘变蓝色,这是碘的特征反应,鸡蛋清和碘不反应,二者现象不同,可鉴别,故D正确.
故选B.
本题解析:
本题难度:简单
2、实验题 黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
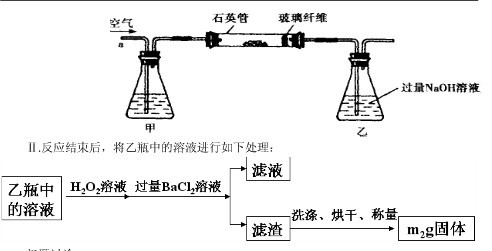
Ⅰ、将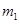 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2?
2Fe2O3+8SO2?
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
[实验二]测定铁元素的含量。
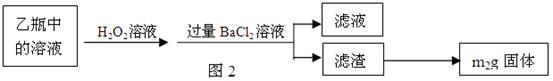
Ⅲ、测定铁元素含量的实验步骤如图3所示:
问题讨论:
 ?
?
(1)Ⅰ中,甲瓶内所盛试剂是?溶液。乙瓶内发生反应的离子方程式有:
?、?。
(2)Ⅱ中的滤渣在称量前还应进行的操作是?。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是?。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有?。
写出④中反应的离子方程式?。
(5)该黄铁矿中硫元素的质量分数为?。
参考答案:(1)NaOH (2分) 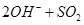 =
=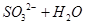 (2分)、
(2分)、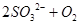 =
=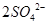 (2分)?(2)洗涤、干燥(2分)?(3)使
(2分)?(2)洗涤、干燥(2分)?(3)使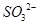 完全转化成
完全转化成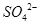 (2分)
(2分)
(4)250ml 容量瓶(2分)? 5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O(2分)?
(5)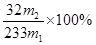 (2分)
(2分)
本题解析:(1)由于空气中含有CO2和水蒸气,所以必须除去,以防止干扰后面的SO2的吸收,因此盛放的是氢氧化钠溶液。SO2是酸性氧化物,能被氢氧化钠溶液吸收,反应的方程式是SO2+2OH-=SO32-+H2O。又因为亚硫酸钠极易被氧气氧化,所以还可能发生反应2SO32-+O2=2SO42-。
(2)沉淀在称量之前还需要洗涤和干燥。
(3)为了使溶液中的SO32-完全被氧化生成SO42-,加入的过氧化钠应该是过量的。
(4)由于要稀释至250ml,所以还需要250ml容量瓶。酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,反应的方程式是5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O。
(5)硫酸钡的质量是m2g,物质的量是m2/233mol,则SO2的物质的量是m2/233mol,所以硫元素的质量分数是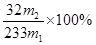 。
。
本题难度:一般
3、实验题 (10分)某教师在课堂上用如图所示的装置来验证浓硫酸与铜是否发生反应,并探讨反应所产生气体的性质 。请回答下列问题:
。请回答下列问题:
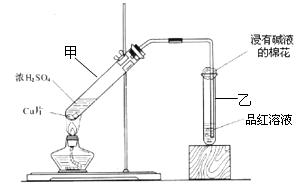
(1)试管乙中发生的现象是
该现象还能说明产生的气体具有 性。
(2)写出试管甲中所发生反应的化学方程式,并标明电子转移方向和数目。
。
(3)试管乙口部浸有碱液的棉花的作用是 ,此防范措施也说明产生的气体是 (填“酸性”、“中性”或“碱性”)气体, (填“有”或“无”)毒性。
(4)SO2的排放是造成酸雨的主要因素,某同学通过实验探究,得出酸雨pH随时间的增加而减小的结论。为进一步研究酸雨的成分,该同学取某一时段的这种雨水V L,加入0.5 mol/ L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
L的Ba(OH)2溶液至不再产生沉淀时,恰好消耗40.00 mL Ba(OH)2溶液。请计算:
①该雨水中共溶解SO2的体积是 mL(标准状况)。
②若生成沉淀物的质量为4.50 g,则沉淀物的组成为 (填写化学式)。
参考答案:(10分)(1)品红溶液褪色; 漂白[
(2)
(3)吸收SO2; 酸性; 有
(4)448; BaSO3和BaSO4。
本题解析:略
本题难度:一般
4、选择题 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验方法不合理的是
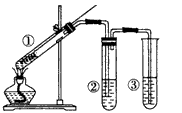
[? ]
A.上下移动①中铜丝可控制SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认CuSO4生成,向①中加水,观察颜色
参考答案:D
本题解析:
本题难度:一般
5、实验题 已知高氯酸铵加热催化分解生成H2O、O2、HCl、Cl2、N2,用如图装置(夹持仪器、加热装置已略去)可以实现该反应。实验中,E内收集到一种纯净的气体,该气体不活泼。

试回答下列问题:
(1)装置B、C均是洗气瓶,C内应装入的液体是______________。
(2)D中应加入的物质是____________,实验中,可观察到的现象是________________________。
(3)E内收集到的气体是___________,该气体化学性质不活泼的原因是_____________________。
(4)为检验反应中生成了氯气,B内应加入的液体是______________。
(5)若B内加入的液体为稀氢氧化钠溶液,则该装置内发生反应的离子方程式为______________。
(6)高氯酸铵催化分解反应中,若生成的HCl、Cl2的物质的量之比为2:1,则生成N2、O2的物质的量之比为_________。
参考答案:(1)浓硫酸
(2)铜网;铜网变黑
(3)氮气;分子内含有氮氮叁键,键能大
(4)KI淀粉溶液
(5)H++OH-=H2O、Cl2+2OH-=H2O+Cl-+ClO-
(6)4:9
本题解析:
本题难度:一般